题目内容
【题目】常温下有下列四种溶液:
① | ② | ③ | ④ | |
溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1molL﹣1的醋酸 | 0.1molL﹣1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10﹣5 . 请回答下列问题:
(1)用④的标准液滴定③宜选用(填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 .
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是(用序号表示),用pH试纸测定溶液pH的操作方法是 .
(3)都是0.1mol/L的①NH4Cl、②NH4HCO3、③CH3COONH4、④NH4HSO4的溶液中NH4+离子浓度大小顺序为 . (用序号填写)
(4)取适量溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为 . 若b点时消耗③的体积为V mL,则V20(填“>”、“<”或“=”). 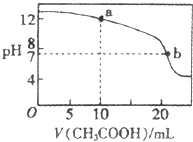
【答案】
(1)酚酞;106:1
(2)③;将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照
(3)④>①>③>②
(4)c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+);>
【解析】解:(1)滴定终点时溶液pH在所选取指示剂变色范围内,醋酸钠溶液呈碱性,其溶液pH>7,酚酞的变色范围为5﹣8,故选酚酞;酸或碱抑制水电离,含有弱离子的盐促进水电离,①②溶液中由水电离出的c(H+)分别为10﹣4mol/L、10﹣10mol/L,所以;①②溶液中由水电离出的c(H+)之比为:10﹣4mol/L:10﹣10mol/L=106:1,所以答案是:酚酞;106:1;(2)加水稀释促进弱电解质电离,强电解质在水溶液中完全电离,所以pH变化最小的是醋酸,用pH试纸测定溶液pH的操作方法是:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,所以答案是:③;将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;(3)H+抑制NH4+水解、CH3COO﹣和HCO3﹣促进NH4+水解,水解程度:CH3COO﹣<HCO3﹣ , 弱酸根离子水解程度越大,NH4+水解程度越大,所以铵根离子浓度大小顺序是④>①>③>②,所以答案是:④>①>③>②;(4)醋酸体积为10mL时,混合溶液中的溶质为等物质的量浓度的CH3COONa、NaOH,溶液呈碱性,溶液中部分CH3COO﹣水解,所以离子浓度大小顺序为c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+);醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量稍微大于NaOH,所以V>20,所以答案是:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+);>.
【考点精析】掌握弱电解质在水溶液中的电离平衡是解答本题的根本,需要知道当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

 阅读快车系列答案
阅读快车系列答案