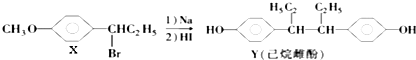��Ŀ����
����Ŀ���̷���FeSO47H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֣���������������м�����������������������ʣ�Ϊԭ�����������̷���һ�ַ����� 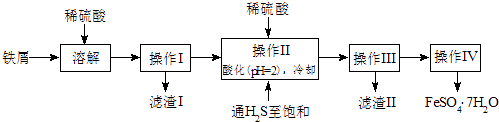
��֪�������±���H2S��Һ��pHԼΪ3.9��SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5��
��1������II�У�ͨ�����������͵�Ŀ����������Һ���������ữ��pH=2��Ŀ���� ��
��2������IV�õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ��ٳ�ȥ������渽�ŵ���������ʣ��� ��
��3���ⶨ�̷���Ʒ��Fe2+�����ķ����ǣ�a����ȡ2.8500g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b����ȡ25.00mL������Һ����ƿ�У�c���������ữ��0.01000mol/LKMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL�� �ٵζ�ʱ������Ӧ�����ӷ���ʽΪ�� ��
�ڵζ�ʱʢ��KMnO4��Һ������Ϊ�����������ƣ����жϴ˵ζ�ʵ��ﵽ�յ�ķ�����
�ۼ���������Ʒ��FeSO47H2O����������Ϊ ��
���𰸡�
��1����ȥ��Һ�е�Sn2+���ӣ�����ֹFe2+����������ֹFe2+�������ɳ���
��2������ϴ�ӹ�����FeSO4?7H2O�����
��3��MnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O����ʽ�ζ��ܣ��μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ��97.54%
���������⣺��м����ϡ�����������������������������˺�õ���Һ������Һ����ϡ�����ữ����ͨ�����⣬������SnS��������ֹ�������ӱ����������˺�õ���ҺΪ����������������Ũ���ᡢ��ȴ�ᾧ�����˿ɵõ�FeSO47H2O����1��ͨ�����������͵�Ŀ���ǣ��������ǿ��ԭ�ԣ����Է�ֹ�������ӱ���������֪����H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5������������Һ���������ữ��pH=2��Ŀ���ǣ�����ҺPH=2ʱ��Sn2+��ȫ�������������Ӳ����������Դ��ǣ���ȥ��Һ�е�Sn2+���ӣ�����ֹFe2+����������ֹFe2+�������ɳ�������2����ˮ�¶ȵͣ������ܽ�ȼ�С������ϴȥ����������������ӣ������̷��ܽ��������ʧ�����Դ��ǣ�����ϴ�ӹ�����FeSO47H2O����ģ���3��������KMnO4��FeSO4��ԭʱ����Mn2+ �� ��Ӧ�����ӷ���ʽΪMnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O�����Դ��ǣ�MnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O���ڸ��������ǿ�����ԣ����Եζ�ʱʢ��KMnO4��ҺҪ����ʽ�ζ��ܣ��ζ�ʵ��ﵽ�յ�ʱ���μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ�����Դ��ǣ���ʽ�ζ��ܣ��μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ����a����ȡ2.8500g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b����ȡ25.00mL������Һ����ƿ�У� c���������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL����
5Fe2++ | MnO4��+ | 8H+ | �T | 5Fe3++ | Mn2++ | 4H2O |
5 | 1 |
n��Fe2+�� 0.01000mol/L��0.0200L
����õ���n��Fe2+��=0.001mol��
��250mL��Һ�к�Fe2+=0.001mol�� ![]() =0.01mol��
=0.01mol��
FeSO47H2O���ʵ���Ϊ0.01mol������=0.01mol��278g/mol=2.78g��
��������= ![]() ��100%=97.54%��
��100%=97.54%��
���Դ��ǣ�97.54%��

 ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�