题目内容
【题目】已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2 , 且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题: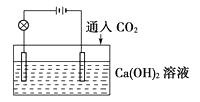
(1)通入CO2前,灯泡(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度。
(3)继续通入过量的CO2 , 灯泡的亮度。
(4)下列四个图中,(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。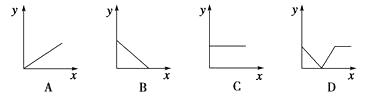
【答案】
(1)亮
(2)先变暗后熄灭
(3)熄灭后又逐渐变亮
(4)D
【解析】(1)灯泡亮,因为Ca(OH)2溶于水后完全电离出离子,溶液中离子的浓度比较大,故灯泡亮。
(2)灯泡先变暗后熄灭,因为发生了CO2+Ca(OH)2=CaCO3↓+H2O,溶液中自由移动的离子减少。
(3)灯泡熄灭后又逐渐变亮:CaCO3+CO2+H2O=Ca(HCO3)2,Ca(HCO3)2完全电离出自由移动的离子,溶液中离子浓度增大。
(4)由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力逐渐增大,所以选D。
根据二氧化碳与氢氧化钙溶液的反应过程中自由离子浓度的变化分析导电性变化即可.

练习册系列答案
相关题目