题目内容
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
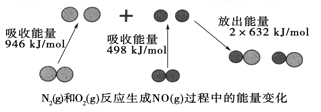
已知①常压下反应的能量变化如图所示。
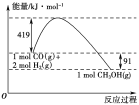
②
化学键 | H—H | H—O | O===O |
键能kJ/mol | 436 | x | 496 |
③CO(g)+1/2O2(g)===CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)===H2O(l) ΔH=-284 kJ/mol
H2O(l)===H2O(g) ΔH=+44 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_______________________。
(2)H—O键的键能x为________ kJ/mol。
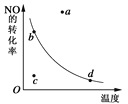
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为________ kJ/mol。
(4)在____(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。
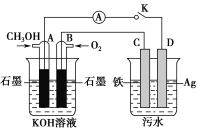
甲 乙
①写出甲池的A极电极反应式:__________________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的________。
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
【答案】CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-757 kJ/mol462510低温CH3OH-6e-+8OH-===CO
O2(g)===CO2(g)+2H2O(l) ΔH=-757 kJ/mol462510低温CH3OH-6e-+8OH-===CO![]() +6H2OC
+6H2OC
【解析】
(1)燃烧热的热化学方程式中,可燃物为1 mol,反应生成稳定的氧化物。根据盖斯定律可得所求热化学方程式。
(2)反应热=反应物总键能-生成物总键能,进而计算x的值。
(3) 由图象判断,活化能为活化分子具有的能量。
(4)CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ/mol的ΔH<0、ΔS<0,ΔH-TΔS<0反应自发进行,故在低温下反应具有自发性。
(5)①甲池的A极为负极,发生氧化反应,碱性环境下生成CO![]() 。
。
②H2SO4能够与氢氧化铁反应;BaSO4不溶于水,不能增大导电能力;Na2SO4与氢氧化铁不发生反应,能够增大导电能力;NaOH能够与显碱性,使得生成的氢氧化铁胶体形成沉淀,;CH3CH2OH属于非电解质,不能增大导电能力,以此解答。
(1)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物。由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,又已知:②CO(g)+![]() O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+
O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-757kJ·mol-1,
O2(g)=CO2(g)+2H2O(l) △H=-757kJ·mol-1,
故答案为:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJ·mol-1;
O2(g)=CO2(g)+2H2O(l)△H=-757kJ·mol-1;
(2)已知:H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+![]() O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+
O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+![]() ×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,
×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,
故答案为:462;
(3)根据图像,甲醇气体分解为CO和H2两种气体的反应的活化能=91 kJ/mol +419 kJ/mol =510 kJ/mol,
故答案为:510;
(4)CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol的△H<0、△S<0,△H-T△S<0反应自发进行,故在低温下反应具有自发性,
故答案为:低温;
(5)①甲池的A极为负极,发生氧化反应,电极反应式为CH3OH - 6e-+ 8OH-=CO32-+ 6H2O,故答案为:CH3OH - 6e-+ 8OH-=CO32-+ 6H2O;
②A.H2SO4能够与氢氧化铁反应,错误;
B.BaSO4不溶于水,不能增大导电能力,错误;
C.Na2SO4与氢氧化铁不发生反应,能够增大导电能力,正确;
D.NaOH能够与显碱性,使得生成的氢氧化铁胶体形成沉淀,错误;
E.CH3CH2OH属于非电解质,不能增大导电能力,错误;
故选C。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案