题目内容
2.图为铁、铜水果电池(酸性)装置示意图,下列说法正确的是( )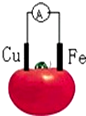
| A. | 铜片为负极 | B. | 铁片上发生还原反应 | ||
| C. | 电流由铁片沿导线流向铜极 | D. | 铜片上的电极方程式:2H++2e-=H2↑ |
分析 根据金属的活泼性知,Fe作负极,Cu作正极,负极上Fe失电子发生氧化反应,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,据此解答.
解答 解:A.该原电池中,Fe的活泼性比Cu强,Fe作负极,故A错误;
B.铁为负极,发生氧化反应,故B错误;
C.Fe作负极,铜作正极,电子从Fe沿导线流向Cu,电流方向与电子流向相反,故C错误;
D.正极上氢离子得电子发生还原反应,电极方程式:2H++2e-=H2↑,故D正确;
故选D.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,难度不大,明确电子的移动方向、电极的判断是解题的关键.

练习册系列答案
相关题目
12.Mg(OH)2固体在水中存在下列溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的( )
| A. | NaOH固体 | B. | NaCl固体 | C. | MgSO4固体 | D. | NaHSO4固体 |
13.下列叙述中,正确的是( )
| A. | 标准状况下,Cl2的摩尔质量为71g | |
| B. | 氧化还原反应一定有氧元素参加 | |
| C. | 国际上规定,0.012kg 12C所含有的碳原子数约为1mol | |
| D. | Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
17.下列相关的叙述中正确的是( )
| A. | 生成物的总能量一定低于反应物总能量 | |
| B. | 吸热反应一定要加热才能进行 | |
| C. | 天然气属于可再生能源和一次能源 | |
| D. | 太阳能的开发利用有助于降低碳排放量 |
14.下列措施不能加快化学反应速率的是( )
| A. | 提高反应物的浓度 | B. | 使用合适的催化剂 | ||
| C. | 降低温度 | D. | 增大压强 |
11.根据下表部分短周期元素的原子半径及主要化合价信息回答以下问题:
(1)E与氢形成的化合物由两种分别是H2O、H2O2,其中心原子的杂化方式分别是sp3、sp3.
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+═Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+═Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
 .
.
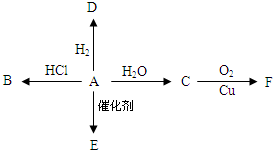 如图所示,已知有机物A的产量可以衡量一个国家的石油化工发展水平,A可以发生如图一系列的反应,按要求回答下列问题
如图所示,已知有机物A的产量可以衡量一个国家的石油化工发展水平,A可以发生如图一系列的反应,按要求回答下列问题