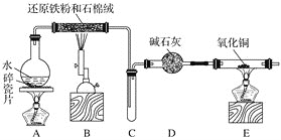
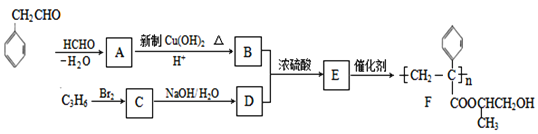
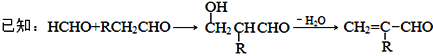
题目内容
【题目】氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为_____________________________________。
(2)下列实验能比较镁和铝的金属性强弱的是____________(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是_____________________________。
(4)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为______以上。
【答案】2Al +2OH-+6H2O = 2 [Al(OH)4]- + 3H2↑c4Al (s)+ 3MnO2 (s) = 3Mn(s) +2Al2O3(s) ΔH=–1789 kJ/mol0.024减小c(Ce4+)[c(OH-)]48
【解析】
(1)Al与NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为:2Al +2OH-+6H2O = 2 [Al(OH)4]- + 3H2↑ ;正确答案: 2Al +2OH-+6H2O = 2 [Al(OH)4]- + 3H2↑。
(2)金属导电性强弱不能证明金属的金属性强弱,a错误;镁离子和铝离子浓度不同,无法比较水解的强弱,从而无法确定金属性强弱,b错误;氢氧化镁不溶于氢氧化钠,而氢氧化铝能够溶于氢氧化钠,说明氢氧化镁的碱性大于氢氧化铝,所以能比较两种金属的金属性的强弱,c正确;正确选项c。
(3)①4Al (s)+3O2(g) =2Al2O3(s) ΔH1=-3352 kJ/mol;②Mn(s)+ O2(g)=MnO2 (s) ΔH2=-521 kJ/mol根据盖斯定律可得①-②×3:Al与MnO2反应冶炼金属Mn的热化学方程式是4Al (s)+ 3MnO2 (s) = 3Mn(s) +2Al2O3(s) ΔH=–1789 kJ/mol;正确答案:4Al (s)+ 3MnO2 (s) =3Mn(s) +2Al2O3(s) ΔH=–1789 kJ/mol。
(4)①5.60gSi3N4(s)的物质的量为5.6/140=0.04mol,根据方程式可以知道参加反应的氢气的物质的量为0.04×6=0.24mol,故H2的平均反应速率是0.24/(2×5)=0.024 mol/(L·min);正确答案:0.024。
②按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,与原平衡投料配比相同,等效为增大压强,该反应正反应是气体体积增大的反应,增大压强,平衡向逆反应移动, SiCl4的转化率减小;因此,本题正确答案是:减小。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4![]() Ce4++4OH-,其溶度积表达式为Ksp=c(Ce4+)×[c(OH-)]4 ;为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,所以1×10-5×[c(OH-)]4=1×10—29,c(OH-)=10-6mol/L;c(H+)=10-8mol/L,pH=8;因此需调节pH为8以上;正确答案:c(Ce4+)[c(OH-)]4 ;8。
Ce4++4OH-,其溶度积表达式为Ksp=c(Ce4+)×[c(OH-)]4 ;为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,所以1×10-5×[c(OH-)]4=1×10—29,c(OH-)=10-6mol/L;c(H+)=10-8mol/L,pH=8;因此需调节pH为8以上;正确答案:c(Ce4+)[c(OH-)]4 ;8。

 阅读快车系列答案
阅读快车系列答案