题目内容
【题目】将FeCl3、CuCl2混合溶液加入一定质量的铁粉中充分反应,所加混合溶液的体积与反应后剩余固体质量如图所示。已知原混合溶液中Fe3+浓度为0.200 mol/L,经检测M点时溶液中无Cu2+;
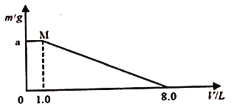
求:
(1)c(CuCl2 )=______mol·L-1。
(2)铁粉的质量_______g。
【答案】 0.700或0.70 44.8
【解析】(1)氧化性是铁离子大于铜离子,铁离子首先氧化金属铁。经检测M点时溶液中无Cu2+,固体质量不变,根据2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu可知消耗的铁的质量与析出的铜的质量相等。设氯化铜的物质的量是xmol,铁离子是0.2mol,则(0.1+x)×56=64x,解得x=0.7,因此c(CuCl2 )=0.7mol÷1L=0.70mol·L-1。(2)加入8L溶液时固体全部溶解,这说明铁只与铁离子反应,铁离子是1.6mol,则铁粉的质量是0.8mol×56g/mol=44.8g。

练习册系列答案
相关题目