��Ŀ����
��14�֣���֪��AΪ���������ӵĵ���ɫ���廯̨�E��XΪ�����г������壬A��B��C��D������ͬ�Ľ������ӣ���ת����ϵ����ͼ�����ֲ�������ȥ����
��ش���������
��1�����ֽ������ӵ����ӽṹʾ��ͼΪ_____________;
��2��X�ĵ���ʽ_______________;
��3��B��������ѧ����������_____________;
���³�ѹ�£�7.8gA��������ˮ��ַ�Ӧ�ų�����a kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ
_________________________________________________________________.
��4����CҲ��ת��ΪB��д����ת���Ļ�ѧ����ʽ_______________________________;
��B��D��Ӧ�����ӷ���ʽΪ_______________________________________.
��5����һ����������Xͨ��2LB����Һ�У���������Һ�б���μ���ϡ����������������������������������ʵ����Ĺ�ϵ��ͼ������������ܽ��HCl�Ļӷ�����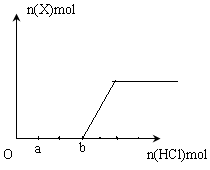
��ش�a����Һ���������ʵĻ�ѧʽΪ__________ ��a��b֮��ķ�Ӧ�����ӷ���ʽ��_________________________��
��14�֣�
��1��Na+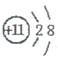 (1��)
(1��)
��2��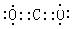 (1��)
(1��)
��3�������ԣ����ۼ������Ӽ���2�֣�2Na2O2(s)+2H2O(l)="4NaOH(aq)+" O2(g)����H=-20akJ/mol(2��)
��4����Ca(OH)2+Na2CO3=CaCO3��+2NaOH�� Ba(OH)2+Na2CO3=BaCO3��+2NaOH
(2��)
��OH-+HCO3-=CO32-+ H2O(2��)
��5��Na2CO3��NaCl (2��) CO32- + H+ = HCO3-(2��)
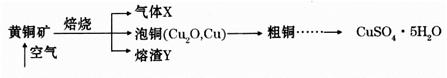
���������������1������ɫ���廯�����ǹ������ƹ��壬����A�ǹ������ƣ���ˮ��Ӧ����������������������E��������B���������ƣ���������������еĶ�����̼��Ӧ������X�Ƕ�����̼��C��̼���ƣ�D��̼�����ơ���A �еĽ����������������ӣ����ӽṹʾ��ͼΪNa+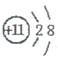 ��
��
��2��X�Ƕ�����̼���ڹ��ۻ��������ʽΪ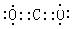
��3��B��NaOH���������Ӽ����й��ۼ���7.8g�Ĺ������Ƶ����ʵ�����0.1mol������1mol��������������ˮ��Ӧ�ų�10akJ�������������������ˮ��Ӧ���Ȼ�ѧ����ʽΪ2Na2O2(s)+2H2O(l)="4NaOH(aq)+" O2(g)����H=-20akJ/mol��
��4����̼����ת��Ϊ�������ƣ��������ֽⷴӦ��̼�������������ƣ���������������Һ��Ӧ����̼��Ƴ������������ƣ����ӷ���ʽΪCa(OH)2+Na2CO3=CaCO3��+2NaOH��
������������̼�����Ʒ�Ӧ����̼���ƺ�ˮ�����ӷ���ʽΪOH-+HCO3-=CO32-+ H2O��
��5����ͼ��֪��HCl��̼���Ʒ�Ӧ������̼�����ƣ������ɶ�����̼������̼�����ƺ����ɶ�����̼���ĵ�HCl�����ʵ�������ͬ�ģ���ͼ�����ɶ�����̼����ǰ���ĵ�HCl�����ɶ�����̼���ĵ�HCl�����ʵ���֮����3:2��˵��������̼���������Ʒ�Ӧ���������ƹ���������a�����HCl���������Ʒ�Ӧ��������Na2CO3��NaCl��a��b֮����̼������HCl��Ӧ����̼�����ƵĹ��̣����ӷ���ʽΪCO32- + H+ = HCO3-��
���㣺���������ƶϣ��������ơ�̼���ơ�̼�����ơ�������̼�Ļ�ѧ���ʣ����ӷ���ʽ����д����ͼ��ķ���

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
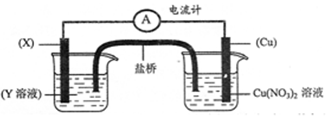
ͬ����չ�Ķ�ϵ�д�����������Һ������������������ͭ����������Ϊ��ȥ���������ʣ��ᴿ����������������Һ�м��˵�������
| A��п�� | B��þ�� | C������ | D������ |
��agþ���Ͻ�Ͷ�뵽x mL 2mol/L�������У�������ȫ�ܽ���ټ���y mL 1mol��L������������Һ���õ��ij������������Ϊ��a+1.7��g������˵������ȷ����
| A��þ���Ͻ������ᷴӦת�Ƶ�������Ϊ0.lNA | B��x��2y |
| C��������Mg(OH)2��Al(OH)3�Ļ���� | D��2x��y |
��16�֣�������ҵ��ϴ�ֲ�ʱ�����ķ�Һ��Ҫ�ɷ�ΪFe2+��H+��Cl-�������������������÷�Һ������������Ʊ�������Ϳ�ϡ� 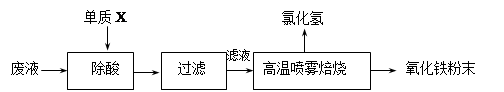
��1������X�Ļ�ѧʽ�� ��
��2���Ȼ�������Һ��������������ת��ΪHCl�������������ĩ���йصĻ�ѧ����ʽ����Ϊ�� ��
��3��ij����Ϳ���г�����Fe2O3�⣬������������CuO��FeO�е�һ��,�����ʵ�鷽����̽��������Ϳ����������ijɷ֡�
�� �����������
����1��������CuO
����2��������FeO
�� ����Ʒ�������֤�������裬д��ʵ�鲽�衢Ԥ������ͽ��ۡ�
��ѡ�Լ������ۡ�3mol?L-1H2SO4��0.1 mol?L-1����KMnO4��Һ��10%NaOH��Һ��10%H2O2��KSCN��Һ
| �������� | Ԥ������ͽ��� |
| ����1��ȡ������Ʒ���Թ��У� ____________________________________________ | ��Ʒȫ���ܽ⣬�õ��������Һ�� |
| ����2�� ����3�� | ___________________________ ___________________________ |
��16�֣�ijУ����ͬѧ�߿�ǰ�������������α�ʵ�飬����ش�ʵ������е�������⣺
��1�����ȷ�Ӧʵ�飺ȡ�����������۰��α��е�ʵ��װ�ã���ͼ���������ȷ�Ӧ������Ӧ
�����á����顱�������ᣬ��Ӧ�����Һ�еμ�KSCN��Һ��������Һ��Ѫ��ɫ��
�ٳ������������ԭ���������顱�п��ܻ���û��Ӧ���
�����������⣬����һ�ֿ���ԭ������ ��
�� ��Ҫ֤����Ӧ���á����顱�к��н����������� ���ѧʽ����Һ����������Ӧ�����ӷ���ʽΪ�� ��
��2����ѧ��Ӧ����Ӱ�����ص�̽��ʵ�飺
KI�ھ��ữ����Һ�б����������ķ�ӦʽΪ��4H+ + 4I-+ O2 = 2I2 + 2H2O���÷�Ӧ���������¶ȡ���ȡ��ܼ����Լ�Ũ�ȵ�Ӱ�죬���õ���������ɫ��Ӧ���۲�÷�Ӧ�����ʡ���֪������������ɫ��Ӧ���¶�����ʱ�����Ȼή�ͣ�����75��������ɫ������Ũ��Խ����ɫԽ��������ɫҲԽ�
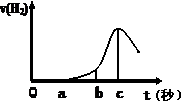
ʵ��С������0.8 mol��L-1 KI��Һ��0.1 mol��L-1H2SO4��Һ��������Һ����̽���¶ȡ���ȶ�������Ӧ���ʵ�Ӱ�죬��������A��C����ʵ�飬����ʵ���������±���
| ��� | �¶�/�� | H2SO4���/mL | KI��Һ���/mL | H2O���/mL | ������Һ / mL | ������ɫʱ�� /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | û������ɫ |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | | | | | | t |
��A��C����ʵ��ʱ����������5mLˮ����Ŀ���� ��
��B��ʵ���С�û������ɫ����ԭ���� ��
������ΪС�����D��ʵ�鷽�����ڱ���հ״���������Ƶ�5�����ݣ�������С�����̽��Ŀ�ꡣ
�ݰ�����Ƶ�ʵ�����ݣ�����Ԥ��һ��tֵ����д������Ԥ�����Ӧ��̽��ʵ���
�� ��
���ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�����������ں��Ӹֹ죬���һ���������ұ�����۵�Ľ����緰�������̵ȡ�
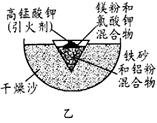

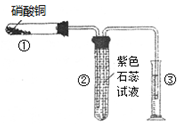
��1��ijУ��ѧ��ȤС��ͬѧ��ȡ�������������̲��е�ʵ��װ�ã���ͼ�ף��������ȷ�Ӧ�������׳�ۡ�ȡ��Ӧ��ġ����顱�������ᣬ�����еμ�KSCN��Һ��������Һ��Ѫ��ɫ���������������ԭ���˿��ܻ���û��Ӧ��Ĵ����������⣬����һ��ԭ������ ����
��2����֤���������á����顱�к��н���������ѡ���� �������Լ����ƣ�����������Ӧ�����ӷ���ʽΪ�� ����
��3��Ϊ�˷�ͼ��ȱ�ݸ���ͼ��װ�ý������ȷ�Ӧ��ȡ��Ӧ��ġ����顱�������ᣬ�����еμ�KSCN��Һ����Һû�г���Ѫ��ɫ��Ϊ�ⶨ��ʵ������ �����顱�ijɷ֣�ʵ��������ͼ��ʾ��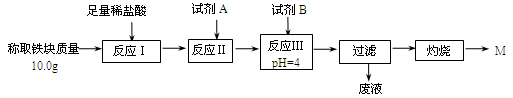
�����������↑ʼ��������ȫ������pH���±���ʾ��
| | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| ��ʼ����ʱ��pH | 7.5 | 2.8 | 4.2 | 9.6 |
| ������ȫʱ��pH | 9.0 | 4.0 | 5 | 11 |
�� �Լ�AӦѡ���� �����Լ�BӦѡ���� ����������ţ�
A��ϡ���� B�������� C��H2O2��Һ D����ˮ E��MgCO3����
�� ��֪������Fe(OH)3��Ksp��1.1��10��36����Ӧ�����Һ��c(Fe3+)���� ��mol��L��1��
�� ������ȫ�ı�־���� ����
�� �����պ�ɫ��δM������Ϊ12.0 g����á����顱�Ĵ������� ������������ù��˹���ֱ��ϴ�ӡ���ɡ����������㡰���顱�Ĵ��ȣ������������ �����ƫ��ƫС������Ӱ�족����ԭ������ ����
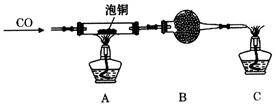
 Cu(NO3)2 �ң�Cu
Cu(NO3)2 �ң�Cu  CuO
CuO 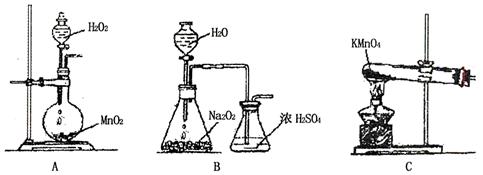
 �ζ���EDTA(H2Y2-)����Һ�ζ����յ�(�ζ����������ʷ�Ӧ)�����ĵζ���b mL���ζ���Ӧ���£�
�ζ���EDTA(H2Y2-)����Һ�ζ����յ�(�ζ����������ʷ�Ӧ)�����ĵζ���b mL���ζ���Ӧ���£�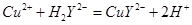 ����CuSO4��5H2O��������Ϊ__________���ζ���������ˮϴ�Ӻ�ֱ��ע�����Һ����ᵼ�²ⶨ���ƫ_______��
����CuSO4��5H2O��������Ϊ__________���ζ���������ˮϴ�Ӻ�ֱ��ע�����Һ����ᵼ�²ⶨ���ƫ_______��