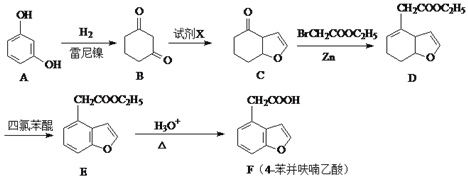
题目内容
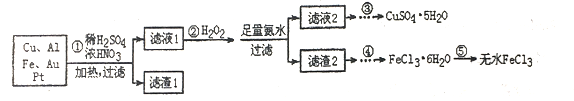
【题目】某研究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为_________________________。
(2)步骤②加H2O2的作用是______________,滤渣2为(填化学式)__________。
(3)步骤⑤不能直接加热脱水的理由是________
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH=________(已知:Ksp[Cu(OH)2]=2.0x10-20)
(5)已知:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080mol·L-1Na2S2O3标准溶液滴定,达到滴定终点的依据是______________。
四次平行实验耗去Na2S2O3标准溶液数据如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
此产品中CuSO4·5H2O的质量分数为__________。
【答案】 Cu+4H++2NO3-= Cu2+ +2NO2↑+2H2O, 3Cu+8H++2NO3-![]() 3Cu2+ +2NO↑+4H2O 将 Fe2+氧化成 Fe3+ Fe(OH)3、A1(OH)3 FcCl3易水解:FeCl3+3H2O
3Cu2+ +2NO↑+4H2O 将 Fe2+氧化成 Fe3+ Fe(OH)3、A1(OH)3 FcCl3易水解:FeCl3+3H2O![]() Fe(OH)3+3HCl ,加热能促进FeCl3的水解,蒸干得不到FeCl3 5 溶液由蓝色褪为无色且半分钟内不恢复原色 83. 3%
Fe(OH)3+3HCl ,加热能促进FeCl3的水解,蒸干得不到FeCl3 5 溶液由蓝色褪为无色且半分钟内不恢复原色 83. 3%
【解析】试题分析:(1)浓硝酸与稀硫酸混合后,可能为浓硝酸也可能为稀硝酸,所以离子方程式为:Cu + 4H++ 2NO3 = Cu2++2NO2↑+ 2H2O或3Cu+8H++2NO3![]() 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
(2)H2O2具有强氧化性,所以H2O2的作用是将Fe2+氧化成Fe3+;加入足量氨水,Fe3+、Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,所以滤渣2为Fe(OH)3、Al(OH)3。
(3)FeCl3为强酸弱碱盐,容易发生水解反应:FeCl3+3H2O![]() Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
(4)c2(OH)c(Cu2+)= Ksp[Cu(OH)2],代入数据可求出c(OH)=1.0×10-9molL1,pH=-lgc(H+)=-lg【Kw÷c(OH)】=5。
(5)Cu2+把I氧化为I2,加入淀粉溶液变蓝,用Na2S2O3标准溶液滴定,达到滴定终点时,Na2S2O3与I2恰好完全反应,所以达到滴定终点的依据是:溶液由蓝色褪为无色且半分钟内不恢复原色;实验3所测数据明显大于其他3组数据,说明实验3出现了实验错误,应舍去,根据其他3组数据求出平均值,根据2Cu2++4I-= 2CuI↓+I2和I2+2S2O32-= 2I-+S4O62-可得对应关系:S2O32- ~ Cu2+,所以n(CuSO45H2O)=n(Cu2+)=n(S2O32- )=0.080 mol·L-1×(25.00+25.02+24.98)/3L=0.002mol,所以此产品中CuSO4·5H2O的质量分数为:0.002mol×250g/mol×5÷3.00g×100%=83.3%

【题目】下列给出的各组物质,不能完成下列转化的是( )
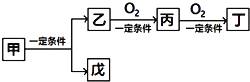
物质 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | C6H12O6 | CH3CH2OH | CH3CHO | CH3COOH | CO2 |
B | NH4Cl | NH3 | N2 | NO2 | HCl |
C | NaCl | Na | Na2O | Na2O2 | Cl2 |
D | CH4 | C | CO | CO2 | H2 |
A. A B. B C. C D. D
【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
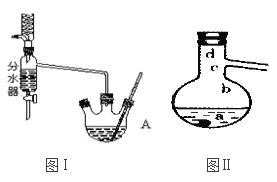
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL乙酸(过量),0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
(1)仪器A的名称是_________,使用分水器(实验中可分离出水)能提高酯的产率,其原因是______________________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),用Na2CO3溶液洗涤的目的是____________,试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①蒸馏过程中需要使用_________形冷凝管,当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶的先后顺序是___________。(填“先a后b"或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。