题目内容
(9分)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几
种形成,对这3种晶体进行实验,结果如下表所示:
(1)晶体的化学式分别为:
A:___________________,B:___________________,C:___________________。
(2)晶体的类型分别为:
A:_______________________,B:_______________________,
C:_______________________。
(3)晶体中粒子间的作用分别为
A:_______________________,B:_______________________,
C:_______________________。
种形成,对这3种晶体进行实验,结果如下表所示:
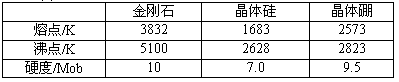
| 项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
| A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| B | 3 500 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
A:___________________,B:___________________,C:___________________。
(2)晶体的类型分别为:
A:_______________________,B:_______________________,
C:_______________________。
(3)晶体中粒子间的作用分别为
A:_______________________,B:_______________________,
C:_______________________。
(1)NaCl 金刚石 HCl
(2)离子晶体 原子晶体 分子晶体
(3)离子键 共价键 分子间作用力
(2)离子晶体 原子晶体 分子晶体
(3)离子键 共价键 分子间作用力
根据A的水溶液与Ag+反应有白色沉淀,说明A的水溶液中有Cl+-,再根据其可以导电得A为NaCl或HCl,又因为其硬度较大,所以判断其为NaCl。
由于B的熔点很高、硬度很大、不导电、不溶于水,可判断其应该为原子晶体,所以B为金刚石。
C的熔点为负、硬度很小,判断其为气体,易溶于水,水溶液与Ag+反应有白色沉淀,所以C为HCl。
(2)A为NaCl,属于离子晶体
B为金刚石,属于原子晶体
C为HCl,属于分子晶体
由于B的熔点很高、硬度很大、不导电、不溶于水,可判断其应该为原子晶体,所以B为金刚石。
C的熔点为负、硬度很小,判断其为气体,易溶于水,水溶液与Ag+反应有白色沉淀,所以C为HCl。
(2)A为NaCl,属于离子晶体
B为金刚石,属于原子晶体
C为HCl,属于分子晶体

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
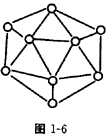
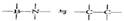 属等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料;另一种是类似于_________的层状结构的混合型晶体,可作用润滑材料,在其结构的每一层上最小的封闭环中有 _________个B原子,B—N键键角为_________。
属等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料;另一种是类似于_________的层状结构的混合型晶体,可作用润滑材料,在其结构的每一层上最小的封闭环中有 _________个B原子,B—N键键角为_________。