题目内容
有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对三种晶体元素进行实验,结果如下表:
根据表中的有关事实,完成下列问题。?
(1)写出晶体的化学式:A ,B ,C 。?
(2)晶体类型:A ,B ,C 。?
(3)组成晶体的微粒:A ,B ,C 。?
(4)晶体中微粒间的作用力:A ,B ,C 。
| 代号 | 熔点 | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
| A | -114.2 ℃ | 很小 | 易溶于水 | 水溶液导电,液态不导电 | 有白色沉淀产生 |
| B | 801 ℃ | 较大 | 易溶于水 | 溶于水或熔化均导电 | 有白色沉淀产生 |
| C | 3 350 ℃ | 很大 | 不溶于水 | 不导电 | 无反应 |
(1)写出晶体的化学式:A ,B ,C 。?
(2)晶体类型:A ,B ,C 。?
(3)组成晶体的微粒:A ,B ,C 。?
(4)晶体中微粒间的作用力:A ,B ,C 。
(1)HClNaClC?
(2)分子晶体离子晶体原子晶体?
(3)HCl分子Na+、Cl-?C原子?
(4)分子间作用力离子键共价键?
(2)分子晶体离子晶体原子晶体?
(3)HCl分子Na+、Cl-?C原子?
(4)分子间作用力离子键共价键?
根据表中所列性质,A的熔点低、硬度小,应为分子晶体,易溶于水且水溶液导电,则为极性分子,可与Ag+反应生成白色沉淀,说明含Cl-,所以A为HCl。B的熔点较高,硬度较大,且易溶于水,溶于水后能导电,说明为离子晶体,能与Ag+反应生成白色沉淀,说明含有Cl-,所以B为NaCl。C的熔点很高,硬度很大,且不溶于水,不导电,应为原子晶体。所以C为金刚石。?

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
 >
>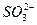 >
>