��Ŀ����
����Ŀ���ڽӴ���������������У�SO2ת����SO3ת���ʵĴ�Сֱ�Ӿ�������Ч�ʡ�ij�о�С������ͼװ��ģ�����������вⶨSO2ת����SO3��ת���ʡ���֪SO3���۵���16.8�����е���44.8��������װ�������漰��Ӧ�Ļ�ѧ����ʽΪ��Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2��+H2O

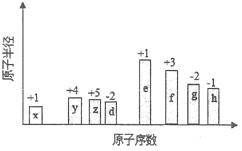
��1�����е��Լ��� ��������������Ϊ ��
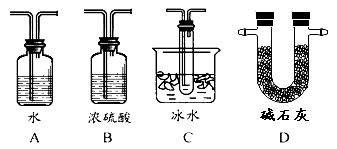
��2������ʵ����Ҫ��Ӧ���������������Ӻ��ʵ�װ�á������ͼA��Dװ����ѡ�����ʺ�װ�ò����������������Ŀո��У������������ӵ�װ�÷ֱ��� �� ��
��3��Ϊ�����SO2��ת���ʣ�ʵ��ʱ�ڣ����μ�Ũ��������ȴ����IJ����У�Ӧ��ȡ�IJ�������_______��_________(����)��
��4��ʵ�������������ռ�SO3���Թܳ���¶���ڿ����У��ܹ������ܿ��д����İ����������������ԭ���� ��
��5����12.6gNa2SO3��ĩ��������Ũ��������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ�����װ����������4.48g����ʵ����SO2��ת����Ϊ ��
���𰸡���1��Ũ���ᣬ�������2��C�� D
��3���� ����4��SO3�ӷ�����������ˮ��5��30%
��������
�����������1��I���Ƶõ�SO2�л���ˮ������Ҫ������ٽ������У�������ʢ��Ũ�������SO2������������������Ϊ�������
��2��SO3���۵���16��8���������ñ�ˮ��ȴ�������������δ��Ӧ���Ķ�������Կ����������Ⱦ�������ü�ʯ�һ�������������Һ������β�������������������ӵ�װ�÷ֱ���C��D��
��3��Ϊ������SO2��ת���ʣ�ʵ��ʱ��Ҫ�����ȴ������ٵμ�Ũ����ʹI����Ӧ��ʼ����SO2��
��4��SO3�ӷ��Ҽ����ܽ���ˮ�����ų������ȣ����ռ�SO3���Թܳ���¶���ڿ����У��ܹ������ܿ��д����İ�����
��5������Ԫ���غ�Na2SO3��SO2����12.6gNa2SO3(��0.1mol)�����ɶ�������0.1mol��װ����������4.48g��˵��ʣ��Ķ�������Ϊ4.48g(��0.07mol)�����Զ��������ת����=(0.1mol-0.7mol)��0.1mol��100%=30%��

 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�