题目内容
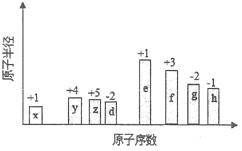
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题
(1)g的原子结构示意图为______________.
(2)比较e、h 简单离子的半径大小(用化学式表示,下同),_______>_________ .
比较g 、h 的最高价氧化物对应的水化物的酸性强弱是:_________>____________.
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________ .
(4)己知lmole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出表示e 的单质燃烧热的热化学方程式:__________________________.
(5)上述元素可组成常见的碱性气体R。回答下列问题:
①.R极易溶于水的原因是(任意写出两点):
A.__________________________.
B.__________________________.
② 用方程式表示R 的溶液显碱性的原因:______________________.
③ 对pH =" 10" 的R 溶液进行下列操作,能使R 的电离平衡逆移的是____________.
A.加入少量 NaCl溶液 B.加入少量1mol.L-1的NH4Cl溶液
C.加入少量MgSO4固体 D.加入少量1mol.L-1 的NaOH溶液
【答案】(1).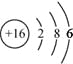 ;
;
(2).Cl->Na+ ,HClO4>H2SO4 ;
(3).![]() ( 或
( 或![]() ,
,![]() )
)
(4).2Na(s)+![]() O2(g)=Na2O2(s) △H=-255.5 kJ/mol-1
O2(g)=Na2O2(s) △H=-255.5 kJ/mol-1
(5).①NH3与H2O能形成分子间氢气键、NH3与H2O能发生反应;
②NH3·H2O![]() NH4++OH-;③BD;
NH4++OH-;③BD;
【解析】试题分析:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。
(1)S原子的结构示意图为 ,故答案为:
,故答案为: ;
;
(2)钠离子核外有2个电子层,氯离子核外有3个电子层,离子半径Cl->Na+,元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性Cl>S,最高价氧化物对应的水化物的酸性HClO4>H2SO4 ,故答案为:Cl->Na+ ,HClO4>H2SO4;
(3)上述元素组成一种四原子共价化合物可能是氨气,双氧水或乙炔等,电子式为![]() ( 或
( 或![]() ,
,![]() ),故答案为:
),故答案为:![]() ( 或
( 或![]() ,
,![]() );
);
(4)lmol钠在足量氧气中燃烧,恢复至室温,放出255.5kJ热量,钠燃烧热的热化学方程式为2Na(s)+![]() O2(g)=Na2O2(s) △H=-255.5 kJ/mol-1,故答案为:2Na(s)+
O2(g)=Na2O2(s) △H=-255.5 kJ/mol-1,故答案为:2Na(s)+![]() O2(g)=Na2O2(s) △H=-255.5 kJ/mol-1;
O2(g)=Na2O2(s) △H=-255.5 kJ/mol-1;
(5)上述元素可组成常见的碱性气体R为氨气。①NH3与H2O能形成分子间氢气键、NH3与H2O能发生反应,使得氨气极易溶于水,故答案为:NH3与H2O能形成分子间氢气键、NH3与H2O能发生反应;
② 氨与水反应生成的一水合氨能够电离出氢氧根离子,溶液显碱性,离子电离方程式为NH3·H2O![]() NH4++OH-,故答案为:NH3·H2O
NH4++OH-,故答案为:NH3·H2O![]() NH4++OH-;
NH4++OH-;
③ 氨水中存在NH3·H2O![]() NH4++OH-。A.加入少量 NaCl溶液,相当于对溶液碱性稀释,促进氨水的电离,错误;B.加入少量1mol.L-1的NH4Cl溶液,增大了铵根离子的浓度,平衡逆向移动,正确;C.加入少量MgSO4固体生成氢氧化镁沉淀,使得氢氧根离子浓度减小,平衡正向移动,错误;D.加入少量1mol/L的NaOH溶液,增大了氢氧根离子浓度,平衡逆向移动,正确;故选BD。
NH4++OH-。A.加入少量 NaCl溶液,相当于对溶液碱性稀释,促进氨水的电离,错误;B.加入少量1mol.L-1的NH4Cl溶液,增大了铵根离子的浓度,平衡逆向移动,正确;C.加入少量MgSO4固体生成氢氧化镁沉淀,使得氢氧根离子浓度减小,平衡正向移动,错误;D.加入少量1mol/L的NaOH溶液,增大了氢氧根离子浓度,平衡逆向移动,正确;故选BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】对下列各组中的实验步骤和现象,分析正确的一项是
选项 | 实验现象 | 原因分析 |
A | 证明酸性条件下H2 O2氧化性比I2强10.关于下列各装置的叙述正确的是( )A.装置①可用于实验室制备NO气体B.装置②可肜于模拟海水蒸馏 C.装置③可用于探究碳酸氢钠的热稳定性 D.装置④为配制溶液过程中的定容操作 11.下列说法正确的是( ) A.将铁粉加入FeCl3、Cucl2混合溶液中,充分反应后剩余的固体中必有铁 B.CO2和SO2混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 C.钠、镁着火时,不可用泡沫灭火器灭火 D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 12.对下列各组中的实验 | 碘化钠溶液 |
B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl、HClO显酸性,使石蕊变红,Cl2具有强氧化性,使褪色 |
C | SO2通入溴水中,溴水褪色 | SO2具有漂白性,使其褪色 |
D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成CO2、SO2 |