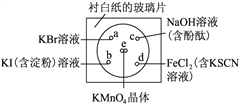
题目内容
【题目】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
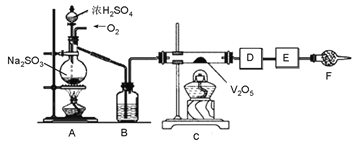
完成下列填空:
(1)A处的化学反应方程式为_______________,仪器F的名称为_____。
(2)根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:__________,E:_________。

(3)用amolNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,则此时SO2的转化率为__________%(用含a、b的代数式表示)。
(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________。
(5)实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是________________________。
【答案】 Na2SO3+ H2SO4(浓)→H2O + SO2↑ + Na2SO4 干燥管 ③ ④ ![]() 或
或![]() 取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质 三氧化硫是一种易升华的固体,在空气中三氧化硫气体易吸收水蒸汽而形成酸雾
取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质 三氧化硫是一种易升华的固体,在空气中三氧化硫气体易吸收水蒸汽而形成酸雾
【解析】(1)A处制备SO2,反应的化学反应方程式为Na2SO3+H2SO4(浓)=H2O+SO2↑+Na2SO4,仪器F的名称为干燥管。(2)SO3的熔点是16.8℃,沸点是44.8℃,所以收集三氧化硫时需要利用冰水冷却,即D处是③;又因为SO2是大气污染物,则E处需要吸收多余的SO2,选择碱石灰,即E处是④;(3)用amolNa2SO3粉末与足量浓硫酸进行此实验,根据硫原子守恒可知生成的SO2是amol。当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,即剩余的SO2是bg,所以此时SO2的转化率为![]() ;(4)Na2SO3变质转化为硫酸钠,所以检验某Na2SO3样品是否变质的方法是取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质;(5)由于三氧化硫是一种易升华的固体,在空气中三氧化硫气体易吸收水蒸汽而形成酸雾,所以实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾。
;(4)Na2SO3变质转化为硫酸钠,所以检验某Na2SO3样品是否变质的方法是取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质;(5)由于三氧化硫是一种易升华的固体,在空气中三氧化硫气体易吸收水蒸汽而形成酸雾,所以实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案