题目内容
4.甲醇是基本有机原料之一,可用于燃料电池、制取MTBE 等有机产品.(1)一种“直接甲醇燃料电池”结构如图1所示,电解质为强酸溶液,该燃料电池负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
(2)水煤气法制取甲醇的反应其反应的焓变、平衡常数如下:
CH4(g)+1/2O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1平衡常数K1
CO(g)+2H2(g)?CH3OH (g)△H2=-90.1kJ•mol-1平衡常数K2
2CH4(g)+O2(g)?2CH3OH(g)△H3 平衡常数K3
△H3=-251kJ•mol-1 (填数值);相同温度下K3=K12•K22(用含K1、K2代数式表示).
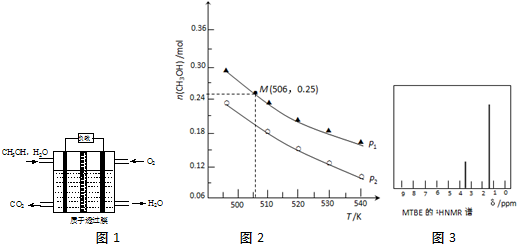
(3)二氧化碳加氢也可合成甲醇[CO2(g)+3H2(g)?CH3OH(g)+H2O(g)],在10.0L的密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如图2所示.
①图2中二氧化碳合成甲醇正反应为放热反应(选填:“放热”或“吸热”).
②图2中压强P1>P2(选填:“>”或“<”).
③在图2中“M”点,平衡常数K=1.04(填数值,保留2位小数).
(4)甲醇与醇ROH在浓硫酸及加热条件下可制备汽油抗爆震剂 MTBE.已知MTBE的分子式为C5H12O,其核磁共振氢谱如图3所示.
①ROH的名称为2-甲基-2-丙醇.
②写出制备MTBE的化学方程式:CH3OH+(CH3)3COH$→_{△}^{浓硫酸}$CH3OC(CH3)3+H2O.
分析 (1)负极发生反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,根据电荷守恒有氢离子生成;
(2)已知:①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1,
②CO(g)+2H2(g)?CH3OH (g)△H2=-90.1kJ•mol-1,
③2CH4(g)+O2(g)?2CH3OH(g)△H3,
盖斯定律,可知①×2+②×2=③,故反应热也进行相应计算,方程式相加时总平衡常数等于分方程的平衡常数之积;
(3)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大;
③M点甲醇物质的量为0.25mol,计算平衡时各组分物质的量浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算;
(4)甲醇与醇ROH在浓硫酸及加热条件下制备汽油抗爆震剂 MTBE,MTBE的分子式为C5H12O,醇ROH为丁醇,MTBE核磁共振氢谱有2个吸收峰,则醇ROH有2种H原子,醇ROH结构简式为(CH3)3COH.
解答 解:(1)负极发生反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,根据电荷守恒有氢离子生成,负极电极反应式为:CH3OH+H2O-6e-=CO2+6H+,
故答案为:CH3OH+H2O-6e-=CO2+6H+;
(2)已知:①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1,
②CO(g)+2H2(g)?CH3OH (g)△H2=-90.1kJ•mol-1,
③2CH4(g)+O2(g)?2CH3OH(g)△H3,
盖斯定律,可知①×2+②×2=③,故△H3=2△H1+2△H2=2×(-35.4kJ•mol-1-90.1kJ•mol-1)=-251kJ•mol-1,则总方程的平衡常数等于分方程的平衡常数之积,则平衡常数K3=K12•K22,
故答案为:0251;K12•K22;
(3)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,故答案为:放热;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,故压强P1>P2,故答案为:>;
③M点甲醇物质的量为0.25mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol):1 2.75 0 0
转化(mol):0.25 0.75 0.25 0.25
平衡(mol):0.75 2 0.25 0.25
容器体积为10L,则平衡时CO2、H2、CH3OH、H2O(g)浓度分别为0.075mol/L、0.2mol/L、0.025mol、L、0.025mol/L,故K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.025×0.025}{0.075×0.{2}^{3}}$=1.04,故答案为:1.04;
(4)甲醇与醇ROH在浓硫酸及加热条件下制备汽油抗爆震剂 MTBE,MTBE的分子式为C5H12O,醇ROH为丁醇,MTBE核磁共振氢谱有2个吸收峰,则醇ROH有2种H原子,醇ROH结构简式为(CH3)3COH.
①ROH的名称为:2-甲基-2-丙醇,故答案为:2-甲基-2-丙醇;
②制备MTBE的化学方程式:CH3OH+(CH3)3COH$→_{△}^{浓硫酸}$CH3OC(CH3)3+H2O,故答案为:CH3OH+(CH3)3COH$→_{△}^{浓硫酸}$CH3OC(CH3)3+H2O.
点评 本题属于拼合型题目,涉及原电池、反应热计算、化学平衡常数、化学平衡影响因素、有机物推断等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

| A. | 常温常压下,16g甲烷所含的质子数为10NA | |
| B. | 常温常压下,18g重水所含的原子数为3NA | |
| C. | 标准情况下,22.4L四氯化碳所含有的分子数为NA | |
| D. | 常温常压下,1mol氦气分子所含有的核外电子数为4NA |
| A. | 碘晶体、碘蒸气是同素异形体 | |
| B. | 固态NaCl和HCl的熔化所克服的作用力不同 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 金刚石和石墨是同位素 |
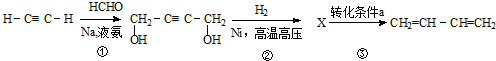
下列说法正确的是( )
| A. | X的结构简式为:HOCH2CH=CHCH2OH | |
| B. | 反应③的转化条件a为:NaOH醇溶液,加热 | |
| C. | 1,3-丁二烯与等物质的量的Br2发生加成,所得产物可能有2种 | |
| D. | ①、②、③的反应类型依次为取代反应、加成反应、消去反应 |
| A. | 用饱和的Na2SO4溶液使鸡蛋清发生盐析,进而分离、提纯蛋白质 | |
| B. | 淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| C. | 苯酚与苯甲酸都能发生加成反应和取代反应 | |
| D. | 汽油和植物油都是碳氢化合物 |
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 分子间作用力越大,分子的热稳定性就越大 | |
| C. | 可能存在不含任何化学键的晶体 | |
| D. | 酸性氧化物形成的晶体一定分子晶体 |
| A. | 主族序数等于原子最外层电子数 | |
| B. | 主族元素最高正化合价等于最外层电子数 | |
| C. | 第n主族元素其最高正化合价为+n价,最低负化合价绝对值为8-n(n≥4) | |
| D. | 第n主族元素其最高价氧化物分子式为R2On,氢化物分子式为RHn(n≥4) |
| X | Y | ||
| Z | W |
| A. | 气态氢化物的热稳定性:X<Y | |
| B. | 最高价氧化物对应水化物的酸性:W>Z>X | |
| C. | X、Y、Z元素均存在同素异形体 | |
| D. | W的单质具有漂白性,能使干燥的有色布条褪色 |
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: