题目内容
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )
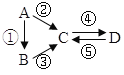
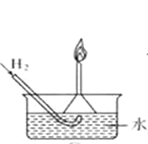
A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
【答案】C
【解析】
试题分析:A.若A是大气中含量最多的气体为N2,C、D是氧化物且会造成光化学污染C为NO,D为NO2,B为NH3;D转化成C的反应化学方程式为:3NO2+H2O=2HNO3+NO,故A正确;B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化.在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H1、△H 2、△H 3,得到:C(s)+![]() O2(g)=CO(g)△H1,C(s)+O2(g)=CO2(g)△H2,CO(g)+
O2(g)=CO(g)△H1,C(s)+O2(g)=CO2(g)△H2,CO(g)+![]() O2(g)=CO2(g)△H3;依据盖斯定律得到△H1+△H3 =△H2,故B正确;C.若C为一元强碱且阴、阳离子所含的电子数相同,判断C为NaOH,D为日常生活中常用的调味品为NaCl,A为Na,B为Na2O2或Na2O,D制备A是电解熔融氯化钠得到,反应的化学方程式为:2NaCl(熔融)
O2(g)=CO2(g)△H3;依据盖斯定律得到△H1+△H3 =△H2,故B正确;C.若C为一元强碱且阴、阳离子所含的电子数相同,判断C为NaOH,D为日常生活中常用的调味品为NaCl,A为Na,B为Na2O2或Na2O,D制备A是电解熔融氯化钠得到,反应的化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑,故C错误;D.若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,判断C为FeCl3,D为FeCl2,保存方法是为防止被氧化和水解,应加入少量铁粉和稀盐酸,故D正确;故选C。
2Na+Cl2↑,故C错误;D.若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,判断C为FeCl3,D为FeCl2,保存方法是为防止被氧化和水解,应加入少量铁粉和稀盐酸,故D正确;故选C。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾