题目内容
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)。
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: 。写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E元素的核电荷数等于A原子和B元素氢化物的核电荷数之和 |
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: 。写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
(1)>(2分) (2)1s22s22p63s23p63d 64s2(或[Ar]3d64s2)(2分)
(3)酸性(1分) 强(1分)
(4)1:2(1分) NH3分子间存在氢键(2分)
(5)
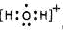 (2分) 2H2O+ + H2S=S↓+ 2H2O+2H+(3分)
(2分) 2H2O+ + H2S=S↓+ 2H2O+2H+(3分) 试题分析:根据题中A、B、C、D、E的信息可确定A~E分别为O、Cl、N、C和Fe。(1)Y为P,P的第一电离能小于Cl的第一电离能;(2)Fe为26号元素,其核外电子排布式为1s22s22p63s23p63d 64s2;(3)盐为NH4NO3,属强酸弱碱盐,因水解而显酸性;高氯酸酸性强于碳酸。(4)N2分子含氮氮三键,
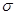 键和
键和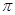 键的个数比为1:2;由于分子间存在氢键,故使其沸点出现反常;(5)H2O释放出一个电子生成H2O+ 其中氧元素为-1价,具有强氧化性。
键的个数比为1:2;由于分子间存在氢键,故使其沸点出现反常;(5)H2O释放出一个电子生成H2O+ 其中氧元素为-1价,具有强氧化性。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 键与
键与 键与个数之比为 ;
键与个数之比为 ;
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol