题目内容
【题目】在恒温恒容条件下,可逆反应:![]() ,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是( )(Qc表示浓度熵)
,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是( )(Qc表示浓度熵)
容器 | 体积 | 起始物质 | 平衡时C的物质的量 | 平衡时B的体积分数 | 平衡常数 |
甲 | 1L |
| 1mol |
|
|
乙 | 1L |
|
|
|
|
丙 | 2L |
|
|
|
|
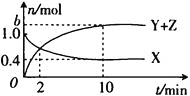
A.在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大
B.![]()
C.升高甲的温度,可使![]()
D.![]() ,
,![]()
【答案】C
【解析】
A.K=![]() ,在反应起始时,Qc(甲)=0,Qc(乙)、Qc(丙)则可认为是无穷大,故在平衡的建立过程中,甲的Qc逐渐增大,乙、丙的Qc逐渐减小,选项A错误;
,在反应起始时,Qc(甲)=0,Qc(乙)、Qc(丙)则可认为是无穷大,故在平衡的建立过程中,甲的Qc逐渐增大,乙、丙的Qc逐渐减小,选项A错误;
B.化学平衡常数只与温度有关,温度相同,其化学平衡常数相同,所以![]() ,选项B错误;
,选项B错误;
C. 若条件是恒压,甲、乙平衡时,B的体积分数相同,但题中的条件是恒容,故乙中压强大于甲,增大压强,平衡向逆反应方向移动,即乙中B的体积分数要大于甲;该反应的正反应是放热反应,升高甲的温度,平衡向逆反应方向移动,导致甲B的体积分数增大,所以存在![]() ,选项C正确;
,选项C正确;
D.由于温度恒定,故K![]() ;
;
对应甲:
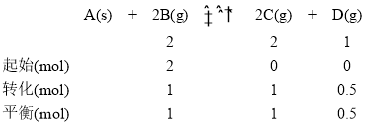
由于体积为1L,则利用物质的量代替浓度计算平衡常数,则平衡常数![]() ,温度相同,化学平衡常数相同即
,温度相同,化学平衡常数相同即![]() ,乙中
,乙中![]() 、
、![]() 、
、![]() ,
,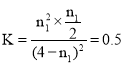 ,
,![]() ;
;
丙中![]() 、
、![]() 、
、![]() ,
,
 ,选项D错误;
,选项D错误;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】已知t℃时,某些物质的平衡常数K的值如表所示,下列说法错误的是( )
物质 | HCIO | H2CO3 | AgCl | AgI |
平衡常数 | Ka≈10﹣9 | K≈10﹣7 K≈10﹣11 | Ksp≈1.8×10﹣10 | Ksp≈8.51×10﹣17 |
A.向新制氯水中加入少量NaHCO3增强氯水漂白性
B.相同温度和浓度下,NaClO溶液的pH比Na2CO3溶液的pH小
C.t℃时,AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
D.将AgCl和AgI的饱和溶液等体积混合,再加入足量AgNO3溶液,会生成等量的AgCl和AgI沉淀