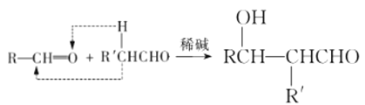
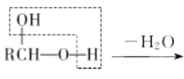题目内容
【题目】已知t℃时,某些物质的平衡常数K的值如表所示,下列说法错误的是( )
物质 | HCIO | H2CO3 | AgCl | AgI |
平衡常数 | Ka≈10﹣9 | K≈10﹣7 K≈10﹣11 | Ksp≈1.8×10﹣10 | Ksp≈8.51×10﹣17 |
A.向新制氯水中加入少量NaHCO3增强氯水漂白性
B.相同温度和浓度下,NaClO溶液的pH比Na2CO3溶液的pH小
C.t℃时,AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
D.将AgCl和AgI的饱和溶液等体积混合,再加入足量AgNO3溶液,会生成等量的AgCl和AgI沉淀
【答案】D
【解析】
A. 由Ka可知,酸性为H2CO3>HClO>HCO3﹣,据此分析判断;
B. 由对应酸的酸性可知,NaClO溶液比Na2CO3溶液的水解程度小;
C. AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=
AgI(s)+Cl﹣(aq)的平衡常数K=![]() ;
;
D. 由Ksp可知,AgCl和AgI的饱和溶液中Cl﹣浓度大于I﹣浓度。
A.由Ka可知,酸性为H2CO3>HClO>HCO3﹣,则向新制氯水中加入少量NaHCO3,HClO浓度增大,增强氯水漂白性,A项正确;
B.由对应酸的酸性可知,NaClO溶液比Na2CO3溶液的水解程度小,则NaClO溶液的pH比Na2CO3溶液的pH小,B项正确;
C.AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=
AgI(s)+Cl﹣(aq)的平衡常数K=![]() =
=![]() =2.1×106,C项正确;
=2.1×106,C项正确;
D.由Ksp可知,AgCl和AgI的饱和溶液中Cl﹣浓度大于I﹣浓度,则再加入足量AgNO3溶液,生成AgCl的量大于AgI沉淀的量,D项错误;
答案选D。

【题目】在恒温恒容条件下,可逆反应:![]() ,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是( )(Qc表示浓度熵)
,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是( )(Qc表示浓度熵)
容器 | 体积 | 起始物质 | 平衡时C的物质的量 | 平衡时B的体积分数 | 平衡常数 |
甲 | 1L |
| 1mol |
|
|
乙 | 1L |
|
|
|
|
丙 | 2L |
|
|
|
|
A.在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大
B.![]()
C.升高甲的温度,可使![]()
D.![]() ,
,![]()
【题目】氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)已知:反应i:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol
反应ii:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式_____。
(2)已知反应i断开1mol化学键所需的能量见下表:
N≡N | H—H | N—H | |
键能/kJ·mol-1 | 945 | 436 | ? |
则断开1molN-H键所需的能量是_______kJ
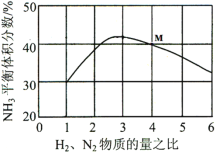
(3)如图表示反应i在500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M点数据计算N2的平衡体积分数______;该反应的化学平衡常数K的表达式______。
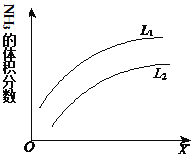
(4)如图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是______(填“温度”或“压强”);判断L1、L2的大小关系并说明理由_______。
(5)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示:
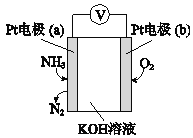
①反应消耗NH3和O2的物质的量之比为____。
②a极的电极反应式为______。