题目内容
【题目】硫酸工业是我国化工生产支柱产业。主要生产工艺流程如下:

接触室中的反应为2SO2(g)+O2(g)![]() 2SO3(g) H=197 kJ·mol1。
2SO3(g) H=197 kJ·mol1。
请回答以下几个问题:
(1)图中炉气要净化的原因是_____________________________________。
(2)吸收塔排出的尾气先用足量的氨水吸收,反应的离子方程式为_______________,再用浓硫酸处理,得到较高浓度的SO2和铵盐。所得的SO2可用于工业制溴过程中吸收潮湿空气中的Br2,吸收Br2的过程中主要反应的化学方程式是____________________________________。所得铵盐溶液中各离子物质的量浓度由大到小的顺序为________________________。
(3)为什么从接触室出来的SO3气体不用水直接吸收,而是用98.3%的浓硫酸吸收:____________________。
![]() (4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
(4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
A.通入过量的空气 B.使用优质催化剂
C.调整适宜的温度 D.采用高压
(5)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图。为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为__________。

【答案】(1)防止接触室内催化剂中毒(1分)
(2)2NH3·H2O+SO22![]() +
+![]() +H2O(2分)
+H2O(2分)
SO2+Br2+2H2OH2SO4+2HBr(1分) c(![]() )>c(
)>c(![]() )>c(H+)>c(OH)(2分)
)>c(H+)>c(OH)(2分)
(3)用水吸收三氧化硫产生大量酸雾,从而阻止了三氧化硫的充分吸收(2分)
(4)1.48(2分) ABC(2分)
(5)16∶29(2分)
【解析】(1)从沸腾炉出来的炉气含有水蒸气、矿尘和杂质气体,净化的目的是防止催化剂中毒。
(2)足量的氨水吸收二氧化硫生成正盐,所以反应的离子方程式是2NH3·H2O+SO22![]() +
+![]() +H2O,SO2吸收潮湿空气中的Br2生成硫酸和氢溴酸:SO2+Br2+2H2OH2SO4+2HBr。得到的铵盐为硫酸铵,溶液中铵根离子水解显酸性,溶液中离子浓度大小为:c(
+H2O,SO2吸收潮湿空气中的Br2生成硫酸和氢溴酸:SO2+Br2+2H2OH2SO4+2HBr。得到的铵盐为硫酸铵,溶液中铵根离子水解显酸性,溶液中离子浓度大小为:c(![]() )>c(
)>c(![]() )>c(H+) > c(OH)。
)>c(H+) > c(OH)。
(3)用水吸收三氧化硫产生大量酸雾,从而阻止了三氧化硫的充分吸收。
(4)设能生成98%的硫酸x t,由工业生产硫酸的反应方程式可得下列关系式:
FeS2 → 2SO2 → 2SO3 → 2H2SO4
120 2×98
1 t×90%×(11.5%) x t×98%
解得x=1.48。
从提高SO3的产率同时适当降低生产成本的角度出发,可采取的措施应是A、B、C三个选项,D项不可取。因为此反应在400~500℃和催化剂的作用下,能较快地转化为三氧化硫,缩短达到平衡所需的时间;但此反应在常压下SO2的平衡转化率已经很高(达90%以上),若采用加压,会提高生产的成本。
(5)发生反应的方程式为2SO2+O2+2H2O2H2SO4,设通入SO2与水的质量比为x∶y,则反应后生成的H2SO4与H2O的质量比一定为1∶1,则 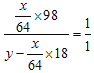 ,整理得
,整理得![]() 。
。