��Ŀ����
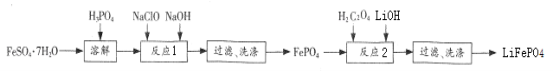
����Ŀ��FePO4��һ��������ˮ�İ�ɫ���壬���ý�����������Ҳ�������Ʊ��綯������ص���������LiFePO4��ʵ��������FeSO47H2O��H3PO4���������Ʊ�FePO4 ��LiFePO4��������ͼ��
�ش��������⣺
(1)���ܽ���ʱH3PO4���˹���̫���ԭ����__________��
(2)��ϴ��FePO4�����IJ�����__________��
���������ϴ�Ӻ�������FePO4���Գ���ɫ������FePO4������ܻ��е�������_____��
(3)����Ӧ1��ʱ�ܷ�Ӧ�����ӷ���ʽ��_____________��
(4)����Ӧ2��ʱ�ܷ�Ӧ�Ļ�ѧ����ʽ����2LiOH + 6H2C2O4 + 2FePO4![]() 2LiFePO4 + 7CO2 + 5X +7H2O ������X�Ļ�ѧʽΪ____��ÿ����1molLiFePO4���÷�Ӧת��_______mole-��
2LiFePO4 + 7CO2 + 5X +7H2O ������X�Ļ�ѧʽΪ____��ÿ����1molLiFePO4���÷�Ӧת��_______mole-��
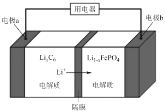
(5)LiFePO4����ȶ��Ըߡ���ȫ���Ի����Ѻã��õ�ص��ܷ�Ӧʽ�ǣ�LiFePO4 + C6 ![]() Li1��xFePO4 + LixC6����ŵ�ʱ����ԭ����ͼ��ʾ��
Li1��xFePO4 + LixC6����ŵ�ʱ����ԭ����ͼ��ʾ��
���ʱ��a���ĵ缫��ӦʽΪ_____________��
�ŵ�ʱ��b���ĵ缫��ӦʽΪ_______________��
���𰸡���ֹ������Ӧ������NaOH���˷�ԭ�� ��©���м�������ˮ�պý�û��������ˮ�������ظ�����2��3�� Fe(OH)3 2 Fe2+ + ClO��+ 2H3PO4 + 4 OH��![]() 2FePO4��+ Cl��+ 5 H2O CO 3.5 C6 + xLi+ + xe��
2FePO4��+ Cl��+ 5 H2O CO 3.5 C6 + xLi+ + xe��![]() LixC6 Li1��xFePO4 + xLi+ + xe��
LixC6 Li1��xFePO4 + xLi+ + xe��![]() LiFePO4
LiFePO4
��������
(1)��ֹ������Ӧ������NaOH���˷�ԭ�ϣ������ܽ���ʱH3PO4���˹���̫�ࣻ
(2)��ϴ��FePO4�����IJ�������©���м�������ˮ�պý�û��������ˮ�������ظ�����2��3�Σ�
���������ϴ�Ӻ�������FePO4���Գ���ɫ������FePO4������ܻ��е�������Fe(OH)3��
(3)����Ӧ1��ʱ�������ӱ�����������������������������������������ӷ�Ӧ�����������������ܷ�Ӧ�����ӷ���ʽ��2 Fe2+ + ClO��+ 2H3PO4 + 4 OH��=2FePO4��+ Cl��+ 5 H2O��
(4)���������غ��֪����Ӧ2LiOH + 6H2C2O4 + 2FePO4![]() 2LiFePO4 + 7CO2 + 5X +7H2O�ұ�����5��C��5��O��X�ļ�����Ϊ5����X�Ļ�ѧʽΪCO����Ӧ��̼Ԫ����+3�۽�Ϊ+2�ۡ���Ԫ����+3�۽�Ϊ+2�ۣ�̼Ԫ����+3����Ϊ+4�ۣ�����������ԭ��Ӧԭ����ÿ����2molLiFePO4��������7mol CO2��ת��7mole-����ÿ����1molLiFePO4���÷�Ӧת��3.5mole-��
2LiFePO4 + 7CO2 + 5X +7H2O�ұ�����5��C��5��O��X�ļ�����Ϊ5����X�Ļ�ѧʽΪCO����Ӧ��̼Ԫ����+3�۽�Ϊ+2�ۡ���Ԫ����+3�۽�Ϊ+2�ۣ�̼Ԫ����+3����Ϊ+4�ۣ�����������ԭ��Ӧԭ����ÿ����2molLiFePO4��������7mol CO2��ת��7mole-����ÿ����1molLiFePO4���÷�Ӧת��3.5mole-��
(5)ԭ������������������ƶ����������缫b�ƶ�����缫bΪ���������ʱb�缫Ϊ����������a����C6�õ��Ӳ���LixC6���缫��ӦʽΪC6 + xLi+ + xe��![]() LixC6��
LixC6��
�ŵ�ʱ������b����Li1��xFePO4�õ��Ӳ���LiFePO4���缫��ӦʽΪLi1��xFePO4 + xLi+ + xe��=LiFePO4��