题目内容
【题目】下列事实能用化学平衡移动原理来解释的是( )
A.加入催化剂,使N2和H2在一定条件下转化为NH3
B.将FeS2矿石粉碎更有利于焙烧制备SO2气体
C.对于反应2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深
H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深
D.用排饱和食盐水的方法收集氯气
【答案】D
【解析】
A、加入催化剂有利于合成氨的反应,使用催化剂,平衡不移动,不能用化学平衡移动原理解释,故A不符合;
B、粉碎矿石后,能够加快化学反应速率,但平衡不移动,不能用化学平衡移动原理解释,故B不符合;
C、对于反应2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强平衡不移动,不能用化学平衡移动原理解释,体系内颜色变深其原因是I2的浓度增加,故C不符合;
H2(g)+I2(g),增大平衡体系的压强平衡不移动,不能用化学平衡移动原理解释,体系内颜色变深其原因是I2的浓度增加,故C不符合;
D、氯气和水的反应方程式为:Cl2+H2O![]() HCl+HClO,该反应是可逆反应,饱和食盐水中Cl-达到饱和,Cl2在饱和食盐水中溶解度较小,所以可以用勒夏特列原理解释,故D正确。
HCl+HClO,该反应是可逆反应,饱和食盐水中Cl-达到饱和,Cl2在饱和食盐水中溶解度较小,所以可以用勒夏特列原理解释,故D正确。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
【题目】已知![]() 在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
pH范围 |
|
|
产物 |
| NO、 |
下列有关说法错误的是![]()
A.碱性条件下,![]() 与NaClO反应的离子方程式为
与NaClO反应的离子方程式为![]()
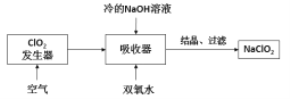
B.向冷的![]() 溶液中通入
溶液中通入![]() 可得到
可得到![]()
C.向冷的![]() 溶液中加入稀硫酸可得到
溶液中加入稀硫酸可得到![]()
D.向冷的![]() 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
溶液中加入滴有淀粉的氢碘酸,溶液变蓝色