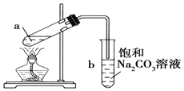
题目内容
【题目】已知![]() 在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液pH的关系如表:
pH范围 |
|
|
产物 |
| NO、 |
下列有关说法错误的是![]()
A.碱性条件下,![]() 与NaClO反应的离子方程式为
与NaClO反应的离子方程式为![]()
B.向冷的![]() 溶液中通入
溶液中通入![]() 可得到
可得到![]()
C.向冷的![]() 溶液中加入稀硫酸可得到
溶液中加入稀硫酸可得到![]()
D.向冷的![]() 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
【答案】B
【解析】
![]() 碱性条件下,
碱性条件下,![]() 的氧化产物为
的氧化产物为![]() ,则
,则![]() 与NaClO反应的离子方程式为
与NaClO反应的离子方程式为![]() ,A正确;
,A正确;
B.![]() 的酸性大于醋酸,醋酸大于碳酸,由强酸制备弱酸的原理可知,碳酸不能制备
的酸性大于醋酸,醋酸大于碳酸,由强酸制备弱酸的原理可知,碳酸不能制备![]() ,B错误;
,B错误;
C.稀硫酸的酸性大于亚硝酸,则根据强酸制备弱酸的原理可知,向冷的![]() 溶液中加入稀硫酸可得到
溶液中加入稀硫酸可得到![]() ,C正确;
,C正确;
D.酸性条件下,![]() 把碘离子氧化为单质碘,单质碘遇到淀粉会变蓝色,所以向冷的
把碘离子氧化为单质碘,单质碘遇到淀粉会变蓝色,所以向冷的![]() 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色,D正确。
溶液中加入滴有淀粉的氢碘酸,溶液变蓝色,D正确。
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】甲醇是一种重要的化工原料.
![]() 已知:
已知:![]()
![]()
写出表示甲醇燃烧热的热化学方程式 ______ .
![]() 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
![]()
![]()
![]()
![]() 该反应的平衡常数表达式为 ______ .
该反应的平衡常数表达式为 ______ .
![]() 下列措施中能使平衡时
下列措施中能使平衡时![]() 减小的是
减小的是![]() 双选
双选![]() ______ .
______ .
A.加入催化剂![]() 恒容充入
恒容充入![]() ,使体系压强增大
,使体系压强增大
C.将![]() 从体系中分离
从体系中分离![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常温下用
甲醇可以氧化成甲酸,在常温下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液过程中,当混合液的
甲酸溶液过程中,当混合液的![]() 时,所消耗的
时,所消耗的![]() ______span>
______span>
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
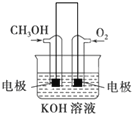
![]() 利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
![]() 合成甲醇的主要反应为:
合成甲醇的主要反应为:![]() 原料气的加工过程中常常混有一些
原料气的加工过程中常常混有一些![]() ,为了研究温度及
,为了研究温度及![]() 含量对该反应的影响,以
含量对该反应的影响,以![]() 、CO和
、CO和![]() 的混合气体为原料在一定条件下进行实验.实验数据见下表:
的混合气体为原料在一定条件下进行实验.实验数据见下表:
|
|
|
|
| ||||||||
反应温度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成![]() 的碳转化率 ______ .
的碳转化率 ______ .
结论二: ______ .
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.用标准溶液润洗滴定管2~3次;
B.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.调节液面至“0”或“0”以下刻度,记下读数;
E.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的现象是______________________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)![]() 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)![]() SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________。
(2)关于CO还原SO2的反应,下列说法正确的是______。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。
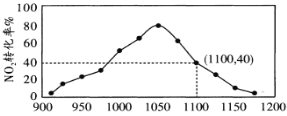
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。