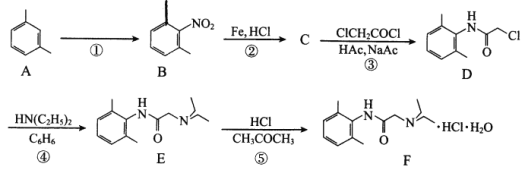
题目内容
【题目】A、B、C、D、E、M、N六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子,其中B的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,M的L层电子数为K层和M层电子数之和,D和M同主族。回答下列问题:
(1)元素B的符号和名称分别是______,_____;在周期表中的位置是____________。
(2)元素C的原子结构示意图为______________________________。
(3)元素C与M可形成CM2,C与N可形成CN4,这两种化合物均可做溶剂,其电子式分别为:_________和_________。
(4)元素A与D、E形成10电子分子的结构式分别为:__________和__________。
(5)元素C和M相比,非金属性较强的是_________(用元素符号表示)。
(6)元素D、M的氢化物的沸点高低顺序为:_________(用化学式表示)。
(7)在一定条件下,A、D的单质和M的最高价氧化物对应水化物的溶液可构成原电池,该电池在放电过程中,电解质溶液的酸性将_________(填“增大”“减小”或“不变”)。
(8)1 mol CA4与D2完全反应生成两种气体时放出热量802kJ,则该反应的热化学方程式为__________________________________________________________________。
【答案】Be 铍 第二周期,ⅡA族 ![]()
![]()
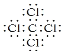 H-O-H H-F F H2O > HF 减小 CH4(g) + O2 (g)==CO2(g) + H2O(g) △H= -802kJ/mol
H-O-H H-F F H2O > HF 减小 CH4(g) + O2 (g)==CO2(g) + H2O(g) △H= -802kJ/mol
【解析】
A、B、C、D、E、M、N六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子,A是H。其中B的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,C是C元素,B是Be。M的L层电子数为K层和M层电子数之和,M是S,N是Cl。D和M同主族,D是O,所以E是F,据此解答。
根据以上分析可知A、B、C、D、E、M、N六种短周期主族元素分别是H、Be、C、O、F、S、Cl。则
(1)元素B的符号和名称分别是Be、铍,原子序数是4,在周期表中的位置是第二周期第ⅡA族。
(2)元素C是碳元素,原子结构示意图为![]() 。
。
(3)元素C与M可形成CS2,C与N可形成CCl4,这两种化合物均是共价化合物,其电子式分别为![]() 、
、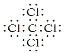 。
。
(4)元素A与D、E形成10电子分子分别是水和氟化氢,结构式分别为H-O-H、H-F。
(5)同周期自左向右非金属性逐渐增强,元素C和M相比,非金属性较强的是F。
(6)常温下水是液体,氟化氢是气体,则元素D、M的氢化物的沸点高低顺序为H2O>HF。
(7)在一定条件下,氢气、氧气和硫酸溶液可构成原电池,总反应式为2H2+O2=2H2O,因此该电池在放电过程中硫酸的浓度减小,所以电解质溶液的酸性将减小。
(8)1 mol甲烷与O2完全反应生成两种气体时放出热量802kJ,则该反应的热化学方程式为CH4(g)+O2 (g)=CO2(g)+H2O(g) △H=-802kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案