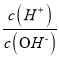题目内容
【题目】铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程如下:
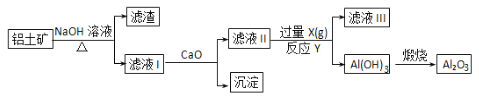
下列说法中错误的是 ( )
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
【答案】C
【解析】
铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为偏铝酸钠和硅酸钠,且含有过量的氢氧化钠,滤渣为氧化铁,在滤液Ⅰ中加入氧化钙,氧化钙和水反应生成氢氧化钙,进而生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成氢氧化铝,煅烧可生成氧化铝。A.由以上分析可知滤液Ⅰ的主要成分为硅酸钠和偏铝酸钠和氢氧化钠,故正确;B.在偏铝酸钠溶液中通入过量的二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,则滤液Ⅲ的含大量的阴离子是碳酸氢根离子,故正确;C.二氧化碳过量,生成碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故错误;D.滤液Ⅱ溶液中含有偏铝酸钠和氢氧化钙,通入过量的二氧化碳,可生成碳酸氢钙,防止氢氧化铝中混有碳酸钙,故正确。故选C。

练习册系列答案
相关题目
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 除去KNO3固体中混杂的NaCl | 降温结晶 | NaCl在水中的溶解度很大 |
C | 分离汽油和水 | 分液 | 汽油和水的密度不同 |
D | 由海水(含NaCl)获得蒸馏水 | 蒸馏 | 水的沸点与NaCl的沸点不司 |
A.AB.BC.CD.D