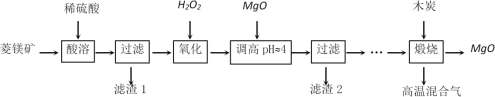
题目内容
【题目】化学上常用AG表示溶液中的lg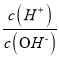 。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
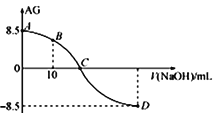
A. 滴定过程中,应选用甲基橙做指示剂
B. B点溶液中存在 c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20 mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-4.5
【答案】D
【解析】试题分析:由图像可知,A点为0.100 molL-1的HNO2溶液,其酸度为8.5,根据水的离子积常数可以求出c(H+)=1![]() mol/L,所以pH=2.75,说明亚硝酸是弱酸。B点所加NaOH溶液的体积为10mL,此时恰好有一半的亚硝酸被中和,溶液中含有等物质的量的亚硝酸和亚硝酸钠。C点酸度为0,溶液呈中性。A. 因为滴定终点是亚硝酸钠溶液,呈碱性,所以,滴定过程中,应选用酚酞做指示剂,A不正确;B. B点溶液中存在着电荷守恒和物料守恒,分别可以表示为c(H+)+ c(Na+)=c(NO2-)+c(OH-)和2c(Na+)= c(NO2-)+c(HNO2),由此可以推出 2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),B不正确;C. C点时pH=7,加入NaOH溶液的体积小于20 mL,C不正确;D. A点c(HNO2)=0.100 molL-1,c(NO2-)=c(H+)=1
mol/L,所以pH=2.75,说明亚硝酸是弱酸。B点所加NaOH溶液的体积为10mL,此时恰好有一半的亚硝酸被中和,溶液中含有等物质的量的亚硝酸和亚硝酸钠。C点酸度为0,溶液呈中性。A. 因为滴定终点是亚硝酸钠溶液,呈碱性,所以,滴定过程中,应选用酚酞做指示剂,A不正确;B. B点溶液中存在着电荷守恒和物料守恒,分别可以表示为c(H+)+ c(Na+)=c(NO2-)+c(OH-)和2c(Na+)= c(NO2-)+c(HNO2),由此可以推出 2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),B不正确;C. C点时pH=7,加入NaOH溶液的体积小于20 mL,C不正确;D. A点c(HNO2)=0.100 molL-1,c(NO2-)=c(H+)=1![]() mol/L,所以,25℃时,HNO2的电离常数Ka=
mol/L,所以,25℃时,HNO2的电离常数Ka=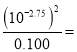 1.0×10-4.5,D正确。本题选D。
1.0×10-4.5,D正确。本题选D。

【题目】用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下

Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。