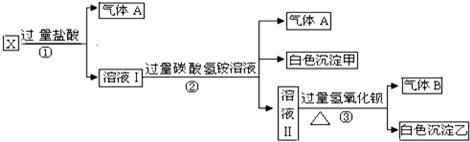
题目内容
12.在500mL NaOH溶液中加入足量铝粉,反应完成后共收集到标准状况下的气体33.6L,该NaOH溶液的浓度为( )| A. | 1mol/L | B. | 1.5 mol/L | C. | 2 mol/L | D. | 3 mol/L |
分析 发生反应:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,根据n=$\frac{V}{{V}_{m}}$计算氢气物质的量,根据方程式计算NaOH物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:氢气物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,
设NaOH的物质的量为x,则:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2 3
x 1.5mol
故x=$\frac{1.5mol×2}{3}$=1mol,
故c(NaOH)=$\frac{1mol}{0.5L}$=2mol/L
故选:C.
点评 本题考查根据方程式的计算,比较基础,明确发生的反应即可解答,注意基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列关于有机化合物的说法正确的是( )
| A. | 医院里常用无水乙醇杀菌、消毒 | |
| B. | 乙醇和乙酸都能与NaOH溶液反应 | |
| C. | 乙酸乙酯中的乙酸可用饱和Na2CO3溶液除去 | |
| D. | 乙烯、聚乙烯和苯分子中均含有碳碳双键 |
17.相同物质的量的Fe、Mg、Al、Na各0.1mol投入到含HCl 0.01mol的稀盐酸中,置换出H2由多到少的顺序是( )
| A. | Al>Mg=Fe>Na | B. | Al=Mg=Fe=Na | C. | Na>Al>Mg>Fe | D. | Al=Mg=Fe<Na |
4.下列有关物理量相应的单位,表达不正确的是( )
| A. | 摩尔质量:g | B. | 密度:g•mL-1 | ||
| C. | 气体摩尔体积:L•mol-1 | D. | 阿伏加德罗常数:mol-1 |
1.下列实验装置能达到实验目的是(夹持仪器未画出)( )
| A. | 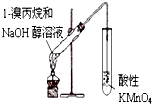 装置用于检验溴丙烷消去产物 | |
| B. | 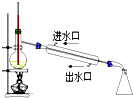 装置用于石油的分馏 | |
| C. | 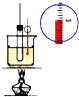 装置用于实验室制硝基苯 | |
| D. | 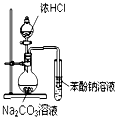 装置可装置证明酸性:盐酸>碳酸>苯酚 |
9.在中和滴定中,下列操作或说法不正确的是( )
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液 | |
| C. | 盛装准确量取的待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整 |