题目内容
17.相同物质的量的Fe、Mg、Al、Na各0.1mol投入到含HCl 0.01mol的稀盐酸中,置换出H2由多到少的顺序是( )| A. | Al>Mg=Fe>Na | B. | Al=Mg=Fe=Na | C. | Na>Al>Mg>Fe | D. | Al=Mg=Fe<Na |
分析 酸不足时,钠可与水反应生成氢气,而Fe、Mg、Al只能与盐酸反应,故Na与酸反应时,Na会完全反应,根据2Na~H2↑计算氢气的物质的量;根据Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,进行过量计算,根据不足量的物质计算生成氢气,相同条件下,体积之比等于物质的量之比.
解答 解:酸不足时,钠可与水反应生成氢气,而Fe、Mg、Al只能与盐酸反应,故Na与酸反应时,Na会完全反应,由2Na~H2↑可知,0.1molNa完全反应,生成氢气的物质的量=0.1mol×$\frac{1}{2}$=0.05mol;
Fe+2HCl=FeCl2+H2↑
0.1mol 0.2mol
故盐酸不足,由方程式可知生成氢气为0.005mol,
Mg+2HCl=MgCl2+H2↑
0.1mol 0.2mol
故盐酸不足,由方程式可知生成氢气为0.005mol,
2Al+6HCl=2AlCl3+3H2↑
0.1mol 0.3mol
故盐酸不足,由方程式可知生成氢气为0.005mol,
相同条件下,体积之比等于物质的量之比,故生成氢气的体积:Al=Mg=Fe<Na,
故选D.
点评 本题考查钠的性质、根据方程式计算,进行过量计算是关键,注意钠和水反应的特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.室温下,对于0.1mol?L-1的氨水,下列有关说法正确的是( )
| A. | 氨水能导电,说明NH3是电解质 | |
| B. | 加水稀释,溶液中的c(OH-)增大 | |
| C. | 加入稀硫酸至溶液的pH=7,c(NH4+)=c(SO42-) | |
| D. | 向含有酚酞的氨水中加入少量NH4Cl晶体,溶液颜色变浅 |
8.某高聚物可表示为图所示,则下列叙述不正确的是( )
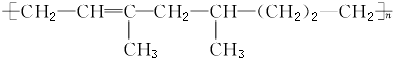
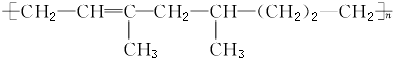
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
5.下列有机反应中,有一种反应类型与其他三种反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 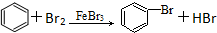 |
12.在500mL NaOH溶液中加入足量铝粉,反应完成后共收集到标准状况下的气体33.6L,该NaOH溶液的浓度为( )
| A. | 1mol/L | B. | 1.5 mol/L | C. | 2 mol/L | D. | 3 mol/L |
2.下列实验操作中正确的是( )
| A. | 蒸发氯化钠溶液时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏石油时,应使温度计水银球插入液面以下 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口放到另一个烧杯 | |
| D. | 检验硫酸根离子的操作是先加硝酸酸化再加入氯化钡溶液 |
9.下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,温度一定时,压强不随时间改变 |
