题目内容
3.(1)0.1mol/L的下列溶液,pH由大到小的排列顺序是ABC.(填序号)A.CH3COOH B.HCl C.H2SO4
(2)体积相同、物质的量浓度相同的CH3COOH溶液与NaOH溶液混合后,溶液呈碱性(填“酸”、“碱”或“中”).
(3)相同条件下pH=3的盐酸和pH=3的醋酸.(填>、<或=)
①取等体积两溶液,分别稀释pH=4时,两者加水量的关系是:前者<后者
②取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者<后者;
③各取两溶液VL,分别加入VL pH=11的NaOH,充分反应后,两溶液pH大小关系是:前者>后者.
分析 (1)硫酸为二元强酸,盐酸为一元强酸,醋酸为一元弱酸,以此解答该题;
(2)相同物质的量的一元弱酸醋酸与一元强碱NaOH反应生成醋酸钠,醋酸根水解导致溶液显碱性;
(3)①醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在电离平衡:CH3COOH?CH3COO-+H+,加水稀释促进电离;
②从弱电解质的电离平衡移动的角度分析;
③相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,加入相同的NaOH,反应后醋酸过量,溶液呈酸性.
解答 解:(1)硫酸为二元强酸,盐酸为一元强酸,醋酸为一元弱酸,溶液c(H+)由小到大的排列顺序是ABC,氢离子浓度越小,pH越大,则pH由大到小的排列顺序是ABC
故答案为:ABC;
(2)相同物质的量的一元弱酸醋酸与一元强碱NaOH反应生成醋酸钠,醋酸根水解导致溶液显碱性,故答案为:碱;
(3)①因为醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在:CH3COOH?CH3COO-+H+,加入水使c(H+)浓度减小,平衡右移,又有部分H+被电离出来,当稀释至c(H+)相同时,需要比强酸盐酸更多的水来稀释,故答案为:<;
②盐酸是强酸,相应的钠盐的水溶液呈中性,即PH=7,醋酸溶液中存在CH3COOH?CH3COO-+H+,加入CH3COONa,溶液CH3COO-浓度增大,抑制醋酸电离,溶液c(H+)减小,所以前者的PH小于后者,故答案为:<;
③相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,盐酸呈中性,而醋酸过量,溶液呈酸性,则盐酸反应后溶液pH大,故答案为:>.
点评 本题考查盐类水解以及酸碱混合的计算和判断以及电解质的比较,题目综合性较强,注意把握弱电解质的电离特点以及电离平衡移动的影响因素.

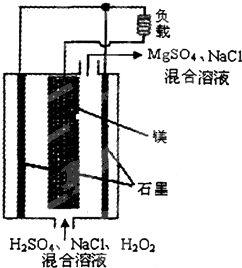 镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )| A. | 电池工作时,H+向正极移动 | |
| B. | 该电池可以在高温下正常工作 | |
| C. | 电池工作时,正极周围溶液的pH将不断变小 | |
| D. | 该电池的总反应式为:Mg+H2O2+H2SO4═MgSO4+2H2O |
| A. | 100 mL 0.5 mol/L MgCl2溶液 | B. | 200 mL 0.25 mol/L AlCl3溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 25 mL 0.5 mol/L HCl溶液 |
| A. | 次氯酸分子的电子式: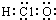 | B. | CH4Si的结构式: | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型: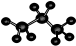 |
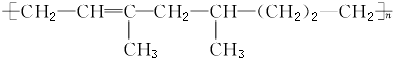
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | ②、④两溶液相比,两者的kw相同 | |
| B. | 四种溶液分别加水稀释10倍,pH变化最大的是①和④ | |
| C. | ①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小 | |
| D. | ①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| A. | 1mol/L | B. | 1.5 mol/L | C. | 2 mol/L | D. | 3 mol/L |
| A. | K1=-K2 | B. | K1=K2 | C. | K1=$\frac{1}{{K}_{2}}$ | D. | K1=$\frac{1}{2}$K2 |