题目内容
【题目】实验室里用二氧化锰与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,计算:
(1)理论上需要参加反应的二氧化锰_______克?
(2)浓盐酸的物质的量浓度为_____________?
(3)被氧化的HCl的质量为______________克?
【答案】21.75g 10mol/L 18.25g
【解析】
氯气的物质的量为:![]() =0.25mol,根据反应的方程式进行计算:
=0.25mol,根据反应的方程式进行计算:
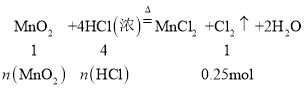
解得n(MnO2)=0.25mol,n(HCl)=1mol,
(1)理论上需要参加反应的MnO2为0.25mol,质量为:0.25mol×87g/mol=21.75g;
(2)n(HCl)=1mol,浓盐酸的体积为100mL,则浓盐酸的物质的量浓度为![]() =10mol/L;
=10mol/L;
(3)根据化学方程式可知,每有4molHCl反应,有2molHCl被氧化,则1molHCl参加反应有0.5mol被氧化,所以被氧化的HCl的质量为:0.5mol×36.5g/mol=18.25g。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目