题目内容
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数的表达式K = ,由上表数据可得,该反应为 反应。(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)="0.01" mol·L-1、c(H2O)="0.03" mol·L-1、c(CO2)="0.01" mol·L-1、c(H2)="0.05" mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小"
 或"不能确定")
或"不能确定")③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 。
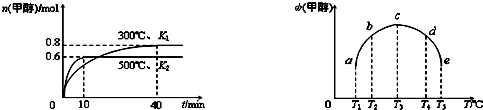
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O
CH3OH(g)+H2O (g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
①平衡时CH3OH的体积分数w为 。
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数
 据如下。下列说法正确的是
据如下。下列说法正确的是 | 容器 | 实验1 | 实验2 | 实验3 |
| 反应物投入量(始态) | 1mol CO2、3mol H2 | 1mol CH3OH、1mol H2O | 2mol CH3OH、2mol H2O |
| CH3OH的平衡浓度/mol·L-1 | C1 | C2 | C3 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ |
| 体系压强/Pa | P1 | P2 | P3 |
| 反应物转化率 | a1 | a2 | a3 |
D.(a1+ a3)<1 E.2P1> P3 F.a1= a2
③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
(1)①K=c(CO)×c(H2O)/c(CO2)×c(H2) (1分),吸热(1分);
②小(1分);③CO2的转化率为1/3(1分)
(2)①30%(2分),②BDE(2分)
③a<b(1分)。[解答]为说明问题方便起见,设原浓度皆为1mol?L-1,加入H2时,H2的浓度增大,设为原浓度的x倍(x>1),CO2、CH3OH、H2O的浓度均减小相同倍数,设为原来浓度的y倍(y<1),则Q(浓度商)= y/x3 K(K为平衡常数),所以Q<K,平衡向正反应方向移动,故得a<b。
解析

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目

 (1)100℃时,该反应的平衡常数:
(1)100℃时,该反应的平衡常数: