题目内容
(12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数

(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。

(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。
(1)①B 3个 ②A 1 ③A 6个 (共6分)
(2)①1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1 (2分)
第四周期ⅢA族 (2分)
②Ga2O3 GaCl3 (2分)
(2)①1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1 (2分)
第四周期ⅢA族 (2分)
②Ga2O3 GaCl3 (2分)
(1)①因为轨道中的电子处于全充满或半充满是稳定的,B稳定,其中未成对电子数3个,答案选B。
②3s的轨道的能量低于3p的,能量越低越稳定,A正确,其中未成对电子数是1个,答案选A。
③因为轨道中的电子处于全充满或半充满是稳定的,A正确,其中未成对电子数是6个,答案选A。
(2)①根据构造原理可知,镓原子的电子排布式为1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1,所以镓元素在元素周期表中的位置第四周期ⅢA族。
②第ⅢA元素的最高价是+3价,所以最高价氧化物、氯化物的化学式分别是Ga2O3、GaCl3。
②3s的轨道的能量低于3p的,能量越低越稳定,A正确,其中未成对电子数是1个,答案选A。
③因为轨道中的电子处于全充满或半充满是稳定的,A正确,其中未成对电子数是6个,答案选A。
(2)①根据构造原理可知,镓原子的电子排布式为1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1,所以镓元素在元素周期表中的位置第四周期ⅢA族。
②第ⅢA元素的最高价是+3价,所以最高价氧化物、氯化物的化学式分别是Ga2O3、GaCl3。

练习册系列答案
相关题目
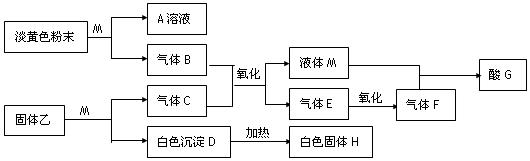
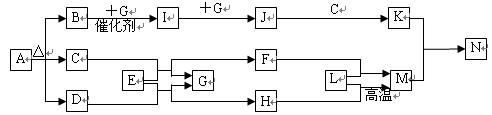
 : 。
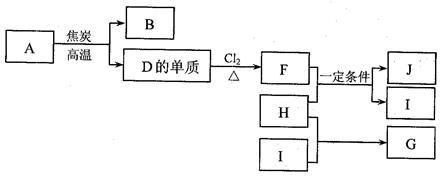
: 。
 ;
;