题目内容
【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
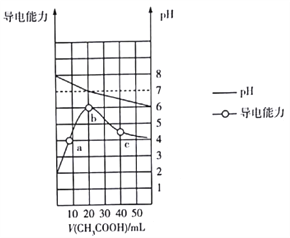
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3<HClO<HF
B. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
C. 若将CO2通入0.lmol/LNa2C03溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
D. 向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO)>c(OH-)
【答案】B
【解析】A项,NaF、NaClO、Na2CO3都属于强碱弱酸盐,0.1mol/L三种溶液的pH:NaF![]() NaClO
NaClO![]() Na2CO3,根据“越弱越水解”规律,酸性HF
Na2CO3,根据“越弱越水解”规律,酸性HF![]() HClO
HClO![]() HCO3-,结合课本知识酸性:H2CO3
HCO3-,结合课本知识酸性:H2CO3![]() HClO,在相同温度下,同浓度的三种酸溶液的导电能力:HF
HClO,在相同温度下,同浓度的三种酸溶液的导电能力:HF![]() HClO,H2CO3
HClO,H2CO3![]() HClO,错误;B项,0.1mol/LNaClO溶液的pH=9.7,溶液中c(H+)=10-9.7mol/L,c(OH-)=10-4.3mol/L,根据水解方程式ClO-+H2O
HClO,错误;B项,0.1mol/LNaClO溶液的pH=9.7,溶液中c(H+)=10-9.7mol/L,c(OH-)=10-4.3mol/L,根据水解方程式ClO-+H2O![]() HClO+OH-,溶液中c(OH-)=c(HClO)=10-4.3mol/L,c(ClO-)=0.1mol/L-10-4.3mol/L
HClO+OH-,溶液中c(OH-)=c(HClO)=10-4.3mol/L,c(ClO-)=0.1mol/L-10-4.3mol/L![]() 0.1mol/L,水解平衡常数K= [c(HClO)·c(OH-)]/ c(ClO-)=(10-4.3)2
0.1mol/L,水解平衡常数K= [c(HClO)·c(OH-)]/ c(ClO-)=(10-4.3)2![]() 0.1=10-7.6,正确;C项,CO2通入Na2CO3溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),溶液呈中性c(H+)=c(OH-),代入电荷守恒得c(HCO3-)+2c(CO32-)=c(Na+)=0.2mol/L,错误;D项,NaClO与HF反应的化学方程式为NaClO+HF=NaF+HClO,两者恰好完全反应得到等物质的量浓度的NaF和HClO的混合液,溶液中存在HClO的电离平衡(HClO
0.1=10-7.6,正确;C项,CO2通入Na2CO3溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),溶液呈中性c(H+)=c(OH-),代入电荷守恒得c(HCO3-)+2c(CO32-)=c(Na+)=0.2mol/L,错误;D项,NaClO与HF反应的化学方程式为NaClO+HF=NaF+HClO,两者恰好完全反应得到等物质的量浓度的NaF和HClO的混合液,溶液中存在HClO的电离平衡(HClO![]() H++ClO-)和NaF的水解平衡(F-+H2O
H++ClO-)和NaF的水解平衡(F-+H2O![]() HF+OH-),HClO的电离和F-的水解都是微弱的,且HClO的电离程度大于F-的水解程度,则溶液中粒子浓度由大到小的顺序为c(Na+)
HF+OH-),HClO的电离和F-的水解都是微弱的,且HClO的电离程度大于F-的水解程度,则溶液中粒子浓度由大到小的顺序为c(Na+)![]() c(F-)
c(F-)![]() c(HClO)
c(HClO)![]() c(H+)
c(H+)![]() c(OH-),错误;答案选B。
c(OH-),错误;答案选B。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案