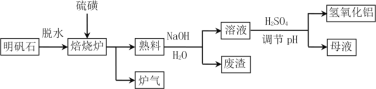
题目内容
【题目】M 是由两种阳离子、一种阴离子和结晶水组成的化合物。某学习小组的同学对该化合物进行了研究。
Ⅰ、取 M 的样品配成溶液,溶液呈棕黄色。将溶液分成三份,做了下列 3 组实验,分别检出 A、B、C 三种离子。请完成下表中的空格:
组别 | 操作 | 实验现象 | 检出的离子 |
第1组 | 加入足量的NaOH溶液并加热 | 产生的气体使湿润的红色石蕊试纸变蓝 | A:_____ |
第 2 组 | 加入KSCN溶液 | 溶液呈_____色 | B:Fe3+ |
第3组 | 加入_____和 BaCl2 溶液 | 有白色沉淀生成 | C: |
Ⅱ.取 9.640g M 配成溶液,加入足量的NaOH溶液,得到红褐色沉淀,将沉淀过滤、洗涤、灼烧,冷却后称量。经过4次灼烧,称量得到的红棕色固体的质量数据如表所示。
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
质量 (g ) | 1.630 | 1.610 | 1.600 | 1.600 |
(1)灼烧和称量时需用图所示的仪器,它们的名称分别是:
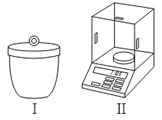
①_____②_____
(2)查阅资料并分析可知红棕色固体为Fe2O3,根据上表数据,可算得Fe2
(3)另取 9.640g M 配成溶液,加入足量的BaCl2溶液,得到白色沉淀,将沉淀过滤、洗涤、干燥,称得其质量为9.320g。小组同学提出 A、B、C 三种离子的物质的量存在以下关系:n (A )+3n (B )=2n (C),他们依据的原理是_____。
(4)分析整个实验过程,可以确定M的化学式为_____。
【答案】NH4+ 血红 稀盐酸 坩埚 电子天平 1.600 电荷守恒 NH4Fe (SO4 )212H2O
【解析】
Ⅰ、第1组加入足量的 NaOH 溶液并加热产生的气体使湿润的红色石蕊试纸变蓝,说明生成氨气;
第 2 组加入 KSCN 溶液,如溶液呈血红色,说明含有Fe3+;
第3组检验SO42﹣,应加入盐酸和氯化钡;
Ⅱ、由表中数据可知红棕色固体为Fe2O3,质量为1.600g,可计算n (Fe3+ ),另取 9.640g M 配成溶液,加入足量的BaCl2溶液,得到白色沉淀,将沉淀过滤、洗涤、干燥,称得其质量为9.320g,应为BaSO4,可计算n (SO42﹣),根据电荷守恒n (A )+3n (B )=2n (C )可计算n (NH4+ ),结合质量守恒计算结晶水,可计算M的化学式。
Ⅰ、第1组加入足量的 NaOH 溶液并加热产生的气体使湿润的红色石蕊试纸变蓝,说明生成氨气,则溶液中存在NH4+;
第 2 组加入KSCN溶液,如溶液呈血红色,说明含有Fe3+;
第3组检验SO42﹣,应加入盐酸和氯化钡,
故答案为:NH4+;血红;稀盐酸;
Ⅱ、 (1 )由仪器图可知Ⅰ为坩埚,Ⅱ为电子天平,故答案为:坩埚;电子天平;
(2 )加热到质量稳定时,可知氧化铁的质量为1.600g,故答案为:1.600;
(3 )溶液中存在的离子分别为NH4+、Fe3+、SO42﹣,存在n (NH4+ )+3n (Fe3+ )=2n (SO42﹣ ),为电荷守恒关系,故答案为:电荷守恒;
(4 )Fe2O3质量为1.600g,n (Fe3+ )=2×![]() =0.02mol,BaSO4质量为9.320g,n (SO42﹣)=
=0.02mol,BaSO4质量为9.320g,n (SO42﹣)=![]() =0.04mol,由n (NH4+ )+3n (Fe3+ )=2n (SO42﹣ ),可知n (NH4+ )=0.02mol,则由质量守恒可知n (H2O )=
=0.04mol,由n (NH4+ )+3n (Fe3+ )=2n (SO42﹣ ),可知n (NH4+ )=0.02mol,则由质量守恒可知n (H2O )=
![]() =0.24mol,
=0.24mol,
则n (NH4+ ):n (Fe3+ ):n (SO42﹣ ):n (H2O )=0.02:0.02:0.04:0.24=1:1:2:12,
所以M的化学式为NH4Fe (SO4 )212H2O,故答案为:NH4Fe (SO4 )212H2O。

【题目】X、Y、Z、W是短周期中的四种常见元素,其相关信息如表:
元素 | 相关信息 |
X | X最外层电子数是次外层电子数的3倍 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
Z | Z和Y同周期,Z的非金属性大于Y |
W | W的一种核素的质量数为23,中子数为12 |
(1)Y位于元素周期表第________周期________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是________(填化学式)。
(2)Z的简单离子的电子式为________。
(3)W可以与X形成两种化合物,写出这两种化合物的电子式:__________________、____________________。