��Ŀ����
����Ŀ�����û�ѧ��Ӧԭ���о��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮
��1����֪�� ![]() O2��g���T
O2��g���T ![]() O2+��g��+
O2+��g��+ ![]() e����H1=+587.9kJ/mol K1
e����H1=+587.9kJ/mol K1
PtF6��g��+e���TPtF6����g����H2=��771.1kJ/mol K2
O2+PtF6����s���TO2+��g��+PtF6����g����H3=+482.2kJ/mol K3
��ӦO2��g��+PtF6��g���TO2+PtF6����s���ġ�H= �� K=����K1��K2��K3��ʾ��
��2��һ�������£������Ժ�CO2������Ӧ��Fe��s��+CO2��g��FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ��K ���¶�T �Ĺ�ϵ��ͼ����ʾ�� 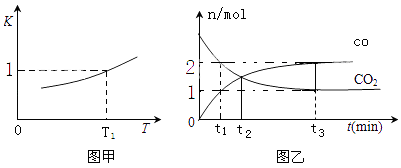
��T�桢p Paѹǿ�µ��ܱ������н��з�Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����������ƽ����Է����������ٱ仯
b��������ѹǿ���ٱ仯
c��v����CO2��=v�� ��FeO��
d��CO2������������ٱ仯
��T1�¶��£������ΪVL���ܱ������м����������۲�����һ������CO2 �� �ﵽƽ��ʱ��CO2��ƽ��ת����Ϊ����Ӧ��������ϵ������������ͣ�
��T2�¶��£������ܱ������У���Ӧ�����вⶨCO��CO2���ʵ�����ʱ��Ĺ�ϵ��ͼ����ʾ����T1T2���������=����CO2��ƽ��ת����Ϊ �� ƽ��ʱ���������ܶ�����ʼʱ������ܶ�֮��Ϊ ��
���𰸡�
��1����77.5kJ/mol��![]()
��2��ad��50%�����ࣻ����66.7%��25��33
���������⣺��1����֪���� ![]() O2��g���T
O2��g���T ![]() O2+��g��+
O2+��g��+ ![]() e����H1=+587.9kJ/mol K1��PtF6��g��+e���TPtF6����g����H2=��771.1kJ/mol K2
e����H1=+587.9kJ/mol K1��PtF6��g��+e���TPtF6����g����H2=��771.1kJ/mol K2
��O2+PtF6����s���TO2+��g��+PtF6����g����H3=+482.2kJ/mol K3
���ݸ�˹���ɣ��١�2�¢ک��ۿɵ�O2��g��+PtF6��g���TO2+PtF6����s������H=��77.5kJ/mol��K= ![]() ��
��
���Դ��ǣ���77.5kJ/mol�� ![]() ����2����Fe��s��+CO2��g��FeO��s��+CO��g������Ӧǰ���������������ķ��ȷ�Ӧ��
����2����Fe��s��+CO2��g��FeO��s��+CO��g������Ӧǰ���������������ķ��ȷ�Ӧ��
a����Ӧǰ���������ʵ������䣬�������������仯����������ƽ����Է����������ٱ仯��˵����Ӧ�ﵽƽ��״̬��a��ȷ��
b����Ӧǰ������������䣬������ѹǿʼ�ղ������仯������˵����Ӧ�ﵽƽ��״̬����b����
c�����������ǹ��壬���ܱ�ʾ��Ӧ���ʣ���c����
d�����ŷ�Ӧ�Ľ��У�CO2�������٣�������������ٱ仯��ƽ��״̬����d��ȷ��
���Դ��ǣ�ad��
��T1�¶��£������ΪV L���ܱ������м����������۲�����һ������CO2 �� ƽ�ⳣ��Ϊ1���������̼��ʼ��Ϊx���仯��Ϊy��
Fe��s��+CO2��g��FeO��s��+CO��g����
��ʼ�� x 0
�仯�� y y
ƽ���� x��y y
ƽ�ⳣ��K= ![]() =1�����
=1����� ![]() =0.5=50%����Ӧ���ȣ���Ӧ������ϵ�������ࣻ
=0.5=50%����Ӧ���ȣ���Ӧ������ϵ�������ࣻ
���Դ��ǣ�50%�����ࣻ
�۸���ͼ�ң��跴Ӧ�����ݻ�ΪV L����K2= ![]() =2����Ӧ���ȣ���ѧƽ�ⳣ������˵����Ӧ�¶Ƚ��ͣ�T1��T2��T2�¶��£��跴Ӧ�����ݻ�ΪV L��ƽ�ⳣ��Ϊ2���������̼��ʼ��Ϊa���仯��Ϊb��
=2����Ӧ���ȣ���ѧƽ�ⳣ������˵����Ӧ�¶Ƚ��ͣ�T1��T2��T2�¶��£��跴Ӧ�����ݻ�ΪV L��ƽ�ⳣ��Ϊ2���������̼��ʼ��Ϊa���仯��Ϊb��
Fe��s��+CO2��g��FeO��s��+CO��g����
��ʼ�� a 0
�仯�� b b
ƽ���� a��b b
ƽ�ⳣ��K= ![]() =2����ã�
=2����ã� ![]() =
= ![]() =66.7%��ƽ��ʱ���������ܶ�����ʼʱ������ܶ�֮��Ϊ����Ħ������֮��
=66.7%��ƽ��ʱ���������ܶ�����ʼʱ������ܶ�֮��Ϊ����Ħ������֮�� ![]() ��44=25��33��
��44=25��33��
���Դ��ǣ����� 66.7%�� 25��33��
�����㾫����������Ĺؼ��������ⷴӦ�Ⱥ��ʱ�����֪ʶ�������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ��Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д�