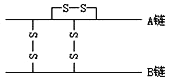
��Ŀ����
����Ŀ��A��B��D���ɳ����Ķ����ڷǽ���Ԫ���γɵĵ��ʣ�������A�ǵ���ɫ��ĩ��B��D�����壬F��G��H����ɫ��Ӧ��Ϊ��ɫ��ˮ��Һ���Լ��ԣ�E��Ư���ԡ�����֮���ת����ϵ��ͼ��ʾ�����ֲ��P��Ӧ��������ȥ�����ش��������⣺
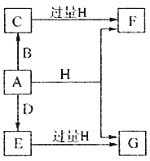
��1��A����Ԫ�������ڱ��е�λ��Ϊ______________��C�ĵ���ʽΪ_______________��
��2��A��H�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ__________________��
��3����A���ڷ��ڵ�G��Һ�п����Ƶû�����I��I��������Һ�в��ȶ��������ɵ����ʵ�����A��E��I����������������A��E�����ӷ���ʽΪ____________________��I����ǿ��ԭ�����ڷ�֯����ֽ��ҵ����Ϊ���ȼ�����I��Һ��ͨ�������ɷ�����Ӧ���μӷ�Ӧ��I�����������ʵ�����Ϊ1:4���÷�Ӧ�����ӷ���ʽΪ__________________��
��4������0.4molF��0.1molG�Ļ����Һ�м���������ᣬ��ȫ��Ӧ���ռ���aL����C����״������ȡ��Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g����a=____________________��
���𰸡� �������� ����A�� ![]() 3S + 6NaOH
3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O 2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O 2H+ + S2O32- ![]() S��+ SO2��+H2O 4Cl2 +S2O32-+ 5H2O
S��+ SO2��+H2O 4Cl2 +S2O32-+ 5H2O![]() 8Cl- + 2SO42- + 10H+ 2.24
8Cl- + 2SO42- + 10H+ 2.24
��������������A�ǵ���ɫ��ĩ����Ϊ���ʣ���A����B��D�����壬A��D����E��E��Ư���ԣ�˵��EΪSO2��D��O2����B��H2��CΪH2S��F��G��H����ɫ��Ӧ��Ϊ��ɫ��F��G��H�о�������Ԫ�أ�ˮ��Һ���Լ��ԣ�SO2��H2S������H��Ӧ��HΪNaOH����FΪNa2S��GΪNa2SO3����1��A�����ʣ�λ�ڵ������ڢ�AԪ�أ�CΪH2S�����ڹ��ۻ���������ʽΪ![]() ����2���������ȵ�����������Һ�����绯��Ӧ���������ƺ��������ƣ�����Ӧ����ʽΪ��3S + 6NaOH
����2���������ȵ�����������Һ�����绯��Ӧ���������ƺ��������ƣ�����Ӧ����ʽΪ��3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O����3��S�ͷ���Na2SO3�õ�������Na2S2O3��Na2S2O3����������������S��SO2�������ӷ�Ӧ����ʽΪ��2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O����3��S�ͷ���Na2SO3�õ�������Na2S2O3��Na2S2O3����������������S��SO2�������ӷ�Ӧ����ʽΪ��2H+ + S2O32- ![]() S��+ SO2��+H2O����������ǿ�����ԣ��ܰ�S2O32��������SO42������������ԭ��Cl����Na2SO3�����������ʵ���֮��Ϊ1��4�������ߵ�ϵ��Ϊ1��4��S2O32����4Cl2��2SO42����8Cl�������ݻ�ѧ��Ӧ����ʽԭ�Ӹ����غ㣬��Ӧǰ��5��O����ȱ��5molH2O������������Ӧ��10H���������ӷ�Ӧ����ʽΪ4Cl2��S2O32����5H2O=8Cl����2SO42����10H������4����Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g�����ݷ�Ӧ2Fe3����S2��=2Fe2����S�����÷�Ӧ�����ĵ�Na2SΪ0.1mol��Na2S��Na2SO3�Ļ����Һ�м���������ᣬ������Ӧ��2S2����SO32����6H��=3S����3H2O������Na2SO3 0.1mol��ʣ���Na2S 0.1mol�����ᷴӦ�ų�H2S���ų�H2S�����ʵ���Ϊ0.1mol����״���µ����Ϊ2.24L��
S��+ SO2��+H2O����������ǿ�����ԣ��ܰ�S2O32��������SO42������������ԭ��Cl����Na2SO3�����������ʵ���֮��Ϊ1��4�������ߵ�ϵ��Ϊ1��4��S2O32����4Cl2��2SO42����8Cl�������ݻ�ѧ��Ӧ����ʽԭ�Ӹ����غ㣬��Ӧǰ��5��O����ȱ��5molH2O������������Ӧ��10H���������ӷ�Ӧ����ʽΪ4Cl2��S2O32����5H2O=8Cl����2SO42����10H������4����Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g�����ݷ�Ӧ2Fe3����S2��=2Fe2����S�����÷�Ӧ�����ĵ�Na2SΪ0.1mol��Na2S��Na2SO3�Ļ����Һ�м���������ᣬ������Ӧ��2S2����SO32����6H��=3S����3H2O������Na2SO3 0.1mol��ʣ���Na2S 0.1mol�����ᷴӦ�ų�H2S���ų�H2S�����ʵ���Ϊ0.1mol����״���µ����Ϊ2.24L��

����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2C2O4 | H2S |
����ƽ�ⳣ�� | 1.8��10��5 | Ka1=5.4��10��2 | Ka1=1.3��10��7 |
��ش��������⣺
��1��H2S��һ�����볣������ʽΪKa1=
��2��CH3COOH��H2C2O4��H2S��������ǿ������˳��
��3��H2C2O4��������KOH��Һ��Ӧ�Ļ�ѧ����ʽ��
��4��NaHS��Һ��NaHC2O4��Һ��Ӧ�����ӷ���ʽ��
��5��H+Ũ����ͬ�������������ҺA�����ᣩ��B��CH3COOH���ֱ���п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ��������˵����ȷ��������д��ţ��� �ٷ�Ӧ����Ҫ��ʱ��B��A
�ڿ�ʼ��Ӧʱ������A��B
�۲μӷ�Ӧ��п�����ʵ���A=B
�ܷ�Ӧ���̵�ƽ������B��A
��B����пʣ�࣮
����Ŀ��ij��ѧ��ȤС��Ҫ����к��ȵIJⶨ��
��1��ʵ�����ϱ��д�С�����ձ�����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β����������0.5molL��1���ᡢ0.55molL��1NaOH��Һ��ʵ����ȱ�ٵIJ�����Ʒ���� ��
��2��ʵ�����ܷ��û���ͭ˿��������滷�β��������������ܡ�������ԭ���� ��
��3�����Ǽ�¼��ʵ���������£�
ʵ����Ʒ | ��Һ�¶� | �к��� | ||
t1 | t2 | ��H | ||
�� | 50 mL0.55 molL��1NaOH��Һ | 20�� | 23.3�� | |
50 mL0.5 molL��1HCl��Һ | ||||
�� | 50 mL0.55 molL��1NaOH��Һ | 20�� | 23.5�� | |
50 mL0.5 molL��1HCl��Һ | ||||
��֪��Q=cm��t2��t1������Ӧ����Һ�ı�����cΪ4.18J����1g��1 �� �����ʵ��ܶȾ�Ϊ1gcm��3 ��
�ټ�������ϱ���H=������2λС������
�ڸ���ʵ����д��NaOH��Һ��HCl��Һ��Ӧ���Ȼ�ѧ����ʽ�� ��
��4������KOH����NaOH���Բⶨ�������С����ޡ���Ӱ�죻���ô������HCl��ʵ�飬�Բⶨ�����С����ޡ���Ӱ�죮