题目内容
下列各组微粒在指定环境中一定可大量共存的是
A. |
B.常温下,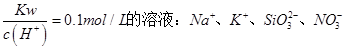 |
C.投入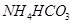 固体能产生气体的溶液: 固体能产生气体的溶液: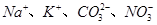 |
D.pH=1的溶液中: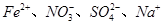 |
B
解析试题分析:A项,醋酸和碳酸根不可共存。B项,该溶液显碱性,可以共存,正确。C项,投入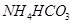 固体能产生气体的溶液,可以是酸性溶液,生成二氧化碳;也可是碱性溶液,产生氨气。D项,亚铁离子可以被硝酸氧化呈铁离子。
固体能产生气体的溶液,可以是酸性溶液,生成二氧化碳;也可是碱性溶液,产生氨气。D项,亚铁离子可以被硝酸氧化呈铁离子。
考点:离子共存

练习册系列答案
相关题目
下列电离方程式错误的是
| A.NaHCO3=Na++ H+ + CO32- | B.NaOH=Na+ + OH- |
| C.H2SO4=2H+ + SO42- | D.KCl=K+ + Cl- |
下列离子方程式中,错误的是
| A.钠和水反应2Na+2H2O=2Na++2OH-+H2↑ |
| B.碳酸钠溶液与稀盐酸反应Na2CO3+2H+=2Na++ CO2↑+H2O |
| C.铁与稀盐酸反应:Fe+2H+=Fe2++H2↑ |
| D.稀硫酸与氢氧化钠溶液反应H++OH一=H2O |
下列方程式不正确的是
| A.用稀H2SO4吸收氨气:NH3+H+=NH4+ |
| B.用CaO吸收汽车尾气中的NOx:CaO+ NO+NO2==Ca(NO2)2 |
| C.向海带灰的浸出液中(酸性)加入双氧水提取I2:2I-+H2O2+2H+==I2+2H2O |
| D.足量铁溶于稀硝酸,溶液变成浅绿色:Fe+4H++NO3-=Fe3++NO↑+2H2O |
下列离子方程式书写正确的是
| A.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+= Cu2++2H2O |
B.实验室制氯气:MnO2+4HCl(浓) 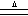 Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| C.用FeS除去工业废水中的Hg2+:Hg2++S2-=HgS↓ |
| D.向次氯酸钠溶液中通入少量二氧化硫:ClO-+ SO2 + H2O = Cl-+SO42- + 2H+ |
有关粒子在相应条件下能大量共存的是
| A.常温常压下混合气体:H2、F2、NO、O2 |
| B.能溶解Al2O3的溶液:NH4+、K+、Cl-、CO32- |
| C.c(H+)="1.0" mol·L-1的溶液中:K+、Fe3+、SO42-、I- |
| D.澄清透明的溶液中:Na+、K+、MnO4-、[Al(OH)4]- |
在下列溶液中,能大量共存的一组离子是
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、ClO- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.通入过量CO2气体的溶液中:Na+、Ba2+、HCO3-、Cl-、Br- |
某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 | 操 作 | 现 象 |
| (1) | 取少许溶液向其中滴加稀盐酸 | 有气泡产生 |
| (2) | 另取少许溶液向其中滴加氯水,及CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列结论正确的是 ( )
A.肯定含有的离子是③④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO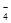 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |