题目内容
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示: 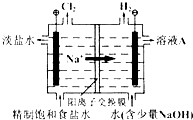
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(4)电解所用的盐水需精制.去除有影响的Ca2+、Mg2+、NH4+、SO42﹣[c(SO42﹣>c(Ca2+)].精致流程如下(淡盐水和溶液A来自电解池): 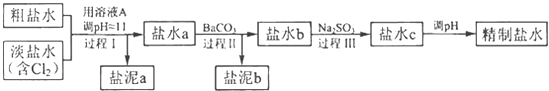
①盐泥a除泥沙外,还含有的物质是 .
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 .
【答案】
(1)NaOH
(2)2Cl﹣+2H2O ![]() ?H2↑+Cl2↑+2OH﹣
?H2↑+Cl2↑+2OH﹣
(3)Cl2与水的反应为Cl2+H2O ![]() ?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
(4)Mg(OH)2;2NH4++3Cl2+8OH﹣═N2↑+6Cl﹣+8H2O;SO42﹣、Ca2+
【解析】解:(1)电解饱和食盐水时,阴极反应式为:2H2O﹣2e﹣═2OH﹣+H2↑,阳极反应式为:2Cl﹣﹣2e﹣═Cl2↑,阴极产物为NaOH和H2 , 阳极产物是Cl2 , 据此可以确定溶液A的溶质是NaOH,所以答案是:NaOH;(2)根据阳极极和阴极的反应式可得电解反应的离子方程式是2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O
H2↑+Cl2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣;(3)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O
H2↑+Cl2↑+2OH﹣;(3)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O ![]() HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
所以答案是:Cl2与水的反应为Cl2+H2O ![]() HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;(4)①根据粗盐水和淡盐水的化学成分,代入题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2 ,
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;(4)①根据粗盐水和淡盐水的化学成分,代入题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2 ,
所以答案是:Mg(OH)2;②将NH4+转化为N2的氧化剂是Cl2 , 对应的离子方程式是2NH4++3Cl2+8OH﹣═N2↑+6Cl﹣+8H2O,
所以答案是:2NH4++3Cl2+8OH﹣═N2↑+6Cl﹣+8H2O;③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42﹣分别转化为CaCO3和BaSO4沉淀除去,
所以答案是:SO42﹣、Ca2+;

 智慧小复习系列答案
智慧小复习系列答案
