题目内容
有aA3+和bBn-两种离子,它们的电子层结构相同,则n值是 ( )
| A.a-3-b | B.b-3-a | C.a+3-b | D.a-3+b |
A
电子层结构相同的粒子具有相同数目的电子数,所以可得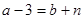 ,得
,得
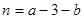 ;
;
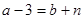 ,得
,得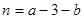 ;
;
练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
题目内容
| A.a-3-b | B.b-3-a | C.a+3-b | D.a-3+b |
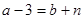 ,得
,得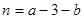 ;
;
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案