题目内容
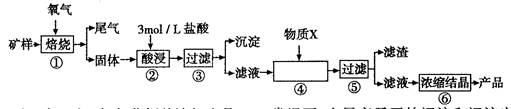
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2?2H2O晶体。
已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
回答下列问题:
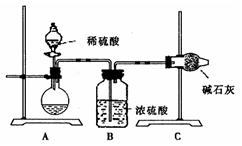
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质、下图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。
若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是____(填字母);若选用甲装置,则烧杯中的下层液体可以是
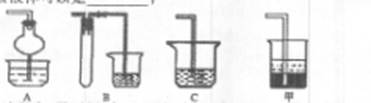
(3)步骤②酸浸过程中,需要用到3 mollL的盐酸l00mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有____;
(4)步骤④加入物质X的目的是 ,物质X可以选用下列物质中的 ;
A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行 次过滤操作。

已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质、下图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式

(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。
若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是____(填字母);若选用甲装置,则烧杯中的下层液体可以是
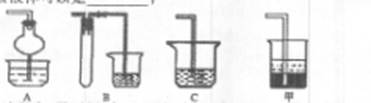
(3)步骤②酸浸过程中,需要用到3 mollL的盐酸l00mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有____;
(4)步骤④加入物质X的目的是 ,物质X可以选用下列物质中的 ;
A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行 次过滤操作。
(1)2H2O2 = 2H2O+O2↑,2Na2O2 + 2H2O= 4NaOH+O2↑
(2)AB 四氯化碳
(3)100ml容量瓶、量筒
(4)调节溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出 A
(5)3
(2)AB 四氯化碳
(3)100ml容量瓶、量筒
(4)调节溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出 A
(5)3
(1)根据装置图可知是固液不加热制气体,所以用H2O2和Na2O2来制取O2反应方程式为:2H2O2 = 2H2O + O2 ↑,2Na2O2 + 2H2O ="4NaOH" + O2 ↑
(2)尾气中含有的是SO2,SO2为酸性氧化物,极易溶于水,可由碱液吸收,但易形成倒吸,故可采用AB装置防倒吸:A中的干燥管可缓冲倒吸、B装置中的试管可做安全瓶;
若选用甲装置,可采用密度大于水的有机溶剂,例如四氯化碳,也可起到防倒吸的作用
(3)配制盐酸一般采取稀释的方法,用量筒量取一定的浓盐酸;
还需要选用100 mL容量瓶的容量瓶进行配制
(4)根据氢氧化物开始沉淀和完全沉淀的pH可知,只要调节pH值,就可以Fe3+以Fe(OH)3沉淀的形式析出,达到除杂的目的。为了不引入新杂质,还能调节pH值,所以选铜的难溶物,如CuO、Cu(OH)2、CuCO3等
(5)除了图示的两次过滤操作外,对CuCl2浓缩结晶后,还需要过滤才可得到产品,故共需要三次过滤操作
(2)尾气中含有的是SO2,SO2为酸性氧化物,极易溶于水,可由碱液吸收,但易形成倒吸,故可采用AB装置防倒吸:A中的干燥管可缓冲倒吸、B装置中的试管可做安全瓶;
若选用甲装置,可采用密度大于水的有机溶剂,例如四氯化碳,也可起到防倒吸的作用
(3)配制盐酸一般采取稀释的方法,用量筒量取一定的浓盐酸;
还需要选用100 mL容量瓶的容量瓶进行配制
(4)根据氢氧化物开始沉淀和完全沉淀的pH可知,只要调节pH值,就可以Fe3+以Fe(OH)3沉淀的形式析出,达到除杂的目的。为了不引入新杂质,还能调节pH值,所以选铜的难溶物,如CuO、Cu(OH)2、CuCO3等
(5)除了图示的两次过滤操作外,对CuCl2浓缩结晶后,还需要过滤才可得到产品,故共需要三次过滤操作

练习册系列答案
相关题目
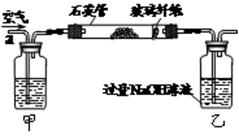
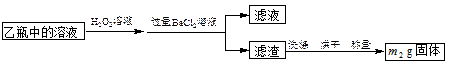

 注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。
注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。 分离操作I和II的操作名称分别是:I ,II 。
分离操作I和II的操作名称分别是:I ,II 。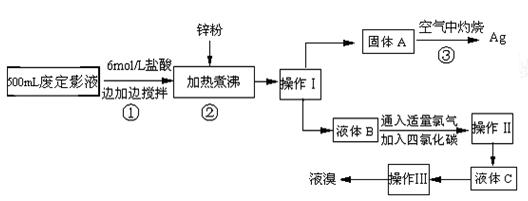
 。
。