题目内容
I.根据价层电子对互斥理论(VSEPR)可以判断分子或离子的空间构型。
请回答下列问题:
①解释CO2为直线型分子的原因 ;
② PbCl2分子的立体构型为 ,该分子属于 分子(填“极性”或“非极性” ),其中Pb原子的杂化轨道类型为 。
II.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
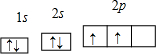
(1)铜原子基态电子排布式为 ;
(2)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g/cm3,则铜晶胞的体积是 cm3,晶胞的质量是 克,阿伏伽德罗常数为 (列式计算,已知Ar(Cu)=63.6)。
I. (1) ①CO2属n+m=2,SP杂化,故为直线形 (每空2分)
②折线形(或V形) 极性分子 SP2 (每空1分)
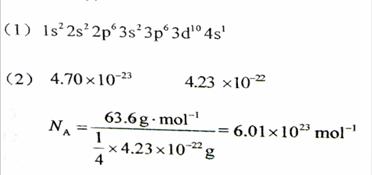 II.
II.
(2分)
(4分)
(3分)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
①三种元素在周期表中位于第 周期
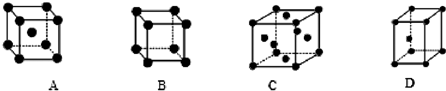
②X晶体采用的堆积方式是下列中 (填字母)
(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是 .
(3)N2O的等电子体为:①分子 ,②阴离子 ;由此可知N2O的中心原子的杂化类型为 .根据价层电子对互斥模型确定NO2的分子构型为 .
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.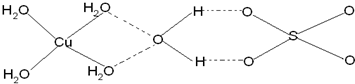
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
②X晶体采用的堆积方式是下列中

(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是
(3)N2O的等电子体为:①分子
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.