题目内容
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
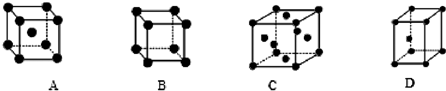
②X晶体采用的堆积方式是下列中
(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是
(3)N2O的等电子体为:①分子
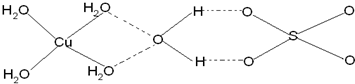
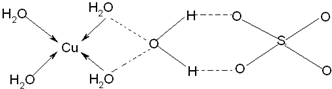
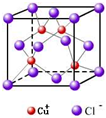
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.
分析:(1)根据元素电离能的变化知,X为第ⅠA族元素、Y为第ⅡA族元素、Z为第ⅢA族元素,
①根据元素的第一电离能知,这几种元素分别是Na、Mg、Al元素;
②钠晶体属于体心立方模型;
(2)氮氮双键键能大于氮氮单键的2倍,氮氮三键的键能大于氮氮三键的3倍,碳碳双键的键能小于碳碳双键的2倍,碳碳三键的键能小于碳碳三键的3倍,键能越大,化学键越牢固;
(3)原子个数相等且价电子数相等的分子为等电子体;根据价层电子对互斥理论确定分子空间构型及原子杂化方式;
(4)含有孤电子对的原子和含有空轨道的原子之间能形成配位键.
①根据元素的第一电离能知,这几种元素分别是Na、Mg、Al元素;
②钠晶体属于体心立方模型;
(2)氮氮双键键能大于氮氮单键的2倍,氮氮三键的键能大于氮氮三键的3倍,碳碳双键的键能小于碳碳双键的2倍,碳碳三键的键能小于碳碳三键的3倍,键能越大,化学键越牢固;
(3)原子个数相等且价电子数相等的分子为等电子体;根据价层电子对互斥理论确定分子空间构型及原子杂化方式;
(4)含有孤电子对的原子和含有空轨道的原子之间能形成配位键.
解答:解:(1)根据元素电离能的变化知,X为第ⅠA族元素、Y为第ⅡA族元素、Z为第ⅢA族元素,
①根据元素的第一电离能知,这几种元素分别是Na、Mg、Al元素,它们属于第三周期元素,
故答案为:三;
②钠晶体属于体心立方模型,8个顶点和体心上各有一个钠原子,
故选A;
(2)氮氮双键键能大于氮氮单键的2倍,氮氮三键的键能大于氮氮三键的3倍,碳碳双键的键能小于碳碳双键的2倍,碳碳三键的键能小于碳碳三键的3倍,键能越大,化学键越牢固,所以乙烯、乙炔中的π键不牢固,而N≡N、N=N的π键非常牢固,
故答案为:乙烯、乙炔中的π键不牢固,而N≡N、N=N的π键非常牢固;
(3)N2O中原子个数是3价电子数是16,①含有3个原子且价电子数是16的有二氧化碳,
故答案为:CO2;
②原子个数为3价电子数为16的离子有SCN- 或N3-等,N2O的中心原子含有2个价层电子对且不含孤电子对,为sp杂化,NO2的中心原子价电子对个数是2.5且含有一个孤电子,为V型,
故答案为:SCN- 或N3-;sp;V型;
(4)该配合物中,铜原子提供空轨道,水中氧原子提供孤电子对,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为:
 ,
,
故答案为: .
.
①根据元素的第一电离能知,这几种元素分别是Na、Mg、Al元素,它们属于第三周期元素,
故答案为:三;
②钠晶体属于体心立方模型,8个顶点和体心上各有一个钠原子,
故选A;
(2)氮氮双键键能大于氮氮单键的2倍,氮氮三键的键能大于氮氮三键的3倍,碳碳双键的键能小于碳碳双键的2倍,碳碳三键的键能小于碳碳三键的3倍,键能越大,化学键越牢固,所以乙烯、乙炔中的π键不牢固,而N≡N、N=N的π键非常牢固,
故答案为:乙烯、乙炔中的π键不牢固,而N≡N、N=N的π键非常牢固;
(3)N2O中原子个数是3价电子数是16,①含有3个原子且价电子数是16的有二氧化碳,
故答案为:CO2;
②原子个数为3价电子数为16的离子有SCN- 或N3-等,N2O的中心原子含有2个价层电子对且不含孤电子对,为sp杂化,NO2的中心原子价电子对个数是2.5且含有一个孤电子,为V型,
故答案为:SCN- 或N3-;sp;V型;
(4)该配合物中,铜原子提供空轨道,水中氧原子提供孤电子对,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为:
 ,
,故答案为:
 .
.点评:本题考查了物质结构和性质,涉及配位键的表示方法、分子空间构型的判断、原子杂化方式的判断、晶体类型等知识点,这些点都是考试热点,知道配位键箭头的指向、空间构型的判断方法、原子杂化方式的判断方法,题目难度中等.

练习册系列答案
相关题目
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如表:
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键的 分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB-离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为 (填代号)
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为 .
③G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2754 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为
②M是含有
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为
⑤AB-离子中和B2分子的π键数目比为
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为
③G2+离子的核外电子排布式为
 下列是部分金属元素的电离能
下列是部分金属元素的电离能 )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。 )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为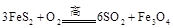 ,有3mol
,有3mol 参加反应,转移
mol电子。
参加反应,转移
mol电子。