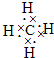题目内容
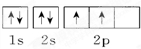
(1)X原子在第二电子层上只有一个空轨道,则X是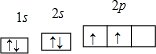
 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是
;R原子的3p轨道上只有一个未成对电子,则R原子可能是
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
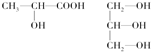
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
C
C
;其轨道表示式为

Al
Al
、Cl
Cl
;Y原子的核电荷数为29,其电子排布式是1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,其在元素周期表中的位置是第四周期第IB族
第四周期第IB族
,是属于ds
ds
区的元素.(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
Co3+
Co3+
、CN-
CN-
、6
6
.(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
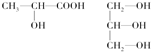
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
①③④⑦
①③④⑦
.(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
>
>
H2SO3; H3PO4>
>
H3PO3.(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
sp3
sp3
杂化,分子的立体构型为V形
V形
.BF3分子中,中心原子的杂化方式为
sp2
sp2
杂化,分子的立体构型为平面正三角形
平面正三角形
.(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
水分子之间存在氢键
水分子之间存在氢键
.分析:(1)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素;
R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素;
Y原子的核电荷数为29,为Cu元素,处于周期表中第四周期第ⅠB族,属于ds区,根据核外电子排布规律书写电子排布式;
(2)配合物中中心离子具有空轨道,配体具有孤对电子,据此判断;
(3)连接4个不同的原子团或原子的碳原子是手性碳原子;
(4)对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子;
(5)将含氧酸HnROm写成ROm-n(OH)n,酸分子中羟基数目为n,非羟基的氧原子数目为N=m-n,以此比较其酸性的强弱.同种元素不同氧化态的含氧酸的n值的大都相同,一般的规律是:元素氧化数的数值越大,N值就越大,含氧酸的酸性就越强;
(6)根据杂化轨道数=σ键数目+孤对电子对数,确定杂化轨道,再结合孤对电子对数确定空间构型;
H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物.
R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素;
Y原子的核电荷数为29,为Cu元素,处于周期表中第四周期第ⅠB族,属于ds区,根据核外电子排布规律书写电子排布式;
(2)配合物中中心离子具有空轨道,配体具有孤对电子,据此判断;
(3)连接4个不同的原子团或原子的碳原子是手性碳原子;
(4)对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子;
(5)将含氧酸HnROm写成ROm-n(OH)n,酸分子中羟基数目为n,非羟基的氧原子数目为N=m-n,以此比较其酸性的强弱.同种元素不同氧化态的含氧酸的n值的大都相同,一般的规律是:元素氧化数的数值越大,N值就越大,含氧酸的酸性就越强;
(6)根据杂化轨道数=σ键数目+孤对电子对数,确定杂化轨道,再结合孤对电子对数确定空间构型;
H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物.
解答:解:(1)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素,轨道表示式为 ;
;
R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素;
Y原子的核电荷数为29,为Cu元素,核外电子排布式为1s22s22p63s23p63d104s1,处于周期表中第四周期第ⅠB族,
故答案为:C; ;Al;Cl;1s22s22p63s23p63d104s1;第四周期第ⅠB族;ds;
;Al;Cl;1s22s22p63s23p63d104s1;第四周期第ⅠB族;ds;
(2)配合物K3[Co(CN)6]中的中心离子为Co3+、配位体是CN-、配位数为6,
故答案为:Co3+、CN-;6;
(3)连接4个不同的原子团或原子的碳原子是手性碳原子,图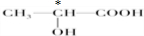 中标“*”为手性碳原子,
中标“*”为手性碳原子,
故答案为: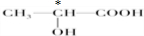 ;
;
(4)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
故选①③④⑦;
(5)H2SO4中S元素化合价为+6,H2SO3中S元素化合价为+4,故酸性H2SO4>H2SO3.H3PO4 中P元素化合价为+5,H3PO3中P元素化合价为+3,故酸性H3PO4>H3PO3,
故答案为:>;>;
(6)H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,采取sp3杂化,故空间结构为V形,
BF3分子中,中心B原子成3个σ键、没有孤对电子,故杂化轨道数为3,采取sp2杂化,故空间结构为平面正三角形,
故答案为:sp3;V形;sp2;平面正三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
 ;
;R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素;
Y原子的核电荷数为29,为Cu元素,核外电子排布式为1s22s22p63s23p63d104s1,处于周期表中第四周期第ⅠB族,
故答案为:C;
 ;Al;Cl;1s22s22p63s23p63d104s1;第四周期第ⅠB族;ds;
;Al;Cl;1s22s22p63s23p63d104s1;第四周期第ⅠB族;ds;(2)配合物K3[Co(CN)6]中的中心离子为Co3+、配位体是CN-、配位数为6,
故答案为:Co3+、CN-;6;
(3)连接4个不同的原子团或原子的碳原子是手性碳原子,图
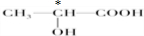 中标“*”为手性碳原子,
中标“*”为手性碳原子,故答案为:
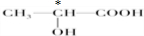 ;
;(4)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
故选①③④⑦;
(5)H2SO4中S元素化合价为+6,H2SO3中S元素化合价为+4,故酸性H2SO4>H2SO3.H3PO4 中P元素化合价为+5,H3PO3中P元素化合价为+3,故酸性H3PO4>H3PO3,
故答案为:>;>;
(6)H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,采取sp3杂化,故空间结构为V形,
BF3分子中,中心B原子成3个σ键、没有孤对电子,故杂化轨道数为3,采取sp2杂化,故空间结构为平面正三角形,
故答案为:sp3;V形;sp2;平面正三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
点评:本题考查元素推断、核外电子排布规律、分子结构与性质、杂化轨道、氢键等,考查的知识点较多,难度中等,注意基础知识的掌握与规律的总结.

练习册系列答案
相关题目