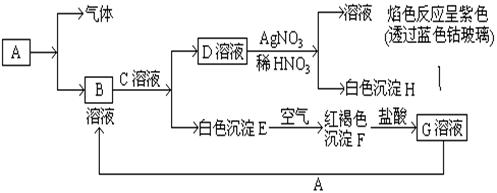
题目内容
(6分)铁和铜作为常见金属,在生活中有着广泛的应用。
(1)硫酸铁在工业上可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,46 g CuFeS2参加反应
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI + Hg = Cu2HgI4 + 2Cu,以上反应中的氧化剂为______; CuI可由Cu2+与I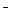 直接反应制得,请配平下列反应的离子方程式: Cu2+ + I
直接反应制得,请配平下列反应的离子方程式: Cu2+ + I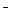 — CuI + I
— CuI + I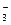
(1)硫酸铁在工业上可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,46 g CuFeS2参加反应
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI + Hg = Cu2HgI4 + 2Cu,以上反应中的氧化剂为______; CuI可由Cu2+与I
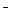 直接反应制得,请配平下列反应的离子方程式: Cu2+ + I
直接反应制得,请配平下列反应的离子方程式: Cu2+ + I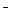 — CuI + I
— CuI + I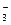
(1)d (2)CuI 2 Cu2+ + 5 I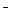 = 2 CuI + 1 I
= 2 CuI + 1 I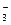
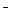 = 2 CuI + 1 I
= 2 CuI + 1 I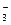
略

练习册系列答案
相关题目