题目内容
【题目】(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
【答案】(8分)(每空1分)
(1)![]() ;(2)
;(2)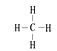 ;SiH4
;SiH4
(3)HNO3>H2CO3 (4)减小 (5)减小 (6)![]() ,离子。
,离子。
【解析】
试题分析:(1)根据元素在周期表中的位置可知⑧元素的Cl,原子核外有3个电子层,最外层有7个电子,因此该原子结构示意图为![]() 。(2)②是C元素,其气态氢化物分子CH4的结构式为
。(2)②是C元素,其气态氢化物分子CH4的结构式为 ,(3)②、③是同一周期的元素,原子序数越大,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3;(4)⑤、⑥元素是同一周期的元素,元素的原子序数越大,元素的金属性就越强,所以元素的金属性强弱顺序是依次为减小的;(5)④、⑤、⑥三种元素形成的简单离子电子层结构相同,元素的原子序数越大,离子半径就越小,离子半径依次减小。(6)①、④、⑤元素分别是H、O、Na,它们可形成既含离子键又含共价键的化合物NaOH,它的电子式是:
,(3)②、③是同一周期的元素,原子序数越大,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3;(4)⑤、⑥元素是同一周期的元素,元素的原子序数越大,元素的金属性就越强,所以元素的金属性强弱顺序是依次为减小的;(5)④、⑤、⑥三种元素形成的简单离子电子层结构相同,元素的原子序数越大,离子半径就越小,离子半径依次减小。(6)①、④、⑤元素分别是H、O、Na,它们可形成既含离子键又含共价键的化合物NaOH,它的电子式是:![]() ,形成的晶体共存微粒是阳离子、阴离子,是离子晶体。
,形成的晶体共存微粒是阳离子、阴离子,是离子晶体。