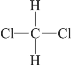
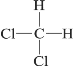
题目内容
【题目】周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X原子核外有6种不同运动状态的电子;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
(1)X位于周期表的第__________________周期,第__________________族。
(2)元素的第一电离能:X__________________Y(填“>”或“<”,下同);原子半径:X__________________Y。
(3)Y的最高价氧化物对应水化物中酸根离子的空间构型__________________(用文字描述)。
(4)Z3+基态核外电子排布式为__________________,用硫氰化钾溶液检验Z3+的离子方程式为__________________。
【答案】二 IVA < > 平面三角形 1s22s22p63s23p63d5或[Ar]3d5 Fe3++3SCN-=Fe(SCN)3
【解析】
周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X原子核外有6种不同运动状态的电子,X为C元素;Y原子基态时2p原子轨道上有3个未成对的电子,Y为N元素;Z有多种氧化物,其中一种红棕色氧化物可作涂料,涂料的为Fe2O3,Z为Fe元素;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态1s22s22p63s23p63d104s1,即为Cu元素;所以前四周期的元素 X、Y、Z、W分别为:C、N、Fe、Cu。
(1)X为碳元素,位于周期表的第二周期第ⅣA族;故答案为:二;ⅣA;
(2)同一周期元素的第一电离能随原子序数的增大而增大,但第ⅡA大于ⅢA,第ⅤA大于ⅥA,所以C小于N元素的第一电离能;同周期原子半径从左向右逐渐减小,所以原子半径:C>N;故答案为:<;>;
(3)根据价层电子对数推出空间结构,N的最高价氧化物对应水化物中酸根离子即NO3-的空间构型:3+![]() =3,价层电子对数为3,孤电子对数为0,所以是平面三角形;故答案为:平面三角形;
=3,价层电子对数为3,孤电子对数为0,所以是平面三角形;故答案为:平面三角形;
(4)Fe基态核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2;失去3个电子后,得出Fe3+的电子排布式为:1s22s22p63s23p63d5或[Ar]3d5;用硫氰化钾溶液检验Z3+生成血红色的络合物,离子方程式为Fe3++3SCN-=Fe(SCN)3;故答案为:1s22s22p63s23p63d5或[Ar]3d5;Fe3++3SCN-=Fe(SCN)3。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案