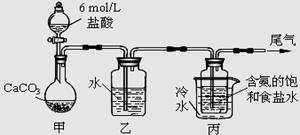
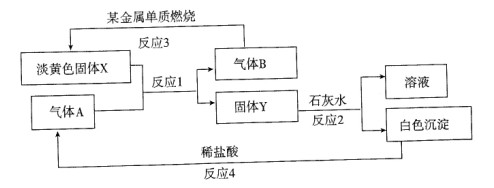
题目内容
铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2 2Cu + SO2
2Cu + SO2
方法二:湿法炼铜: CuSO4 + Fe FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下: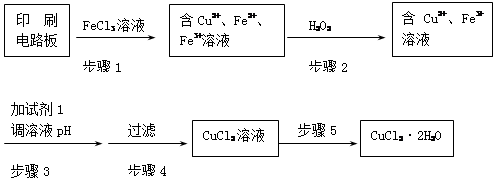
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
(14分)Ⅰ 湿法炼铜(或方法二) (1分) 不会产生污染空气的气体(或湿法炼铜不需要外界提供能量)(1分) 3:2(2分)
Ⅱ ①2Fe2++ H2O2 +2H+ = 2Fe3+ + 2H2O (2分)(不配平给1分)
②CuCl2在溶液中可以发生水解反应: CuCl2+2H2O Cu(OH)2+2HCl, 滴加浓盐酸,可以抑制水解(2分)(方程式1分,文字表述1分)
Cu(OH)2+2HCl, 滴加浓盐酸,可以抑制水解(2分)(方程式1分,文字表述1分)
③ 向漏斗中加少量蒸馏水(水)至没过沉淀,静置滤干后重复操作2~3次。(2分)
④ CuO[或Cu(OH)2] (2分) 4×10-8mol/L (2分)
解析试题分析:Ⅰ 640gCu的物质的量为10mol
方法一:火法炼铜:
Cu2S + O2  2Cu + SO2
2Cu + SO2
↓1×2↑6×1 ↓2×2
所以有关系式
Cu ~ 3e-
10mol 30mol
方法二:湿法炼铜:
CuSO4 + Fe=FeSO4 + Cu
↓2×1 ↑2×1
所以有关系式
Cu ~ 2e-
10mol 20mol
分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为30:20=3:2
Ⅱ①Fe2+能被H2O2氧化生成Fe3+,H2O2被还原成水,方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O
②CuCl2在溶液中可以发生水解反应,加入浓盐酸,可以抑制水解,故答案为:CuCl2在溶液中可以发生水解反应,CuCl2+2H2O Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解;
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解;
③洗涤沉淀,可在过滤器中加入水至淹没沉淀,等水过滤后,重复操作2-3次;
④pH升高到4即c=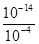 =10-10mol/L,代入Ksp(Fe(OH)3)=4×10-38=c(Fe3+)·c3(OH-),c(Fe3+)=4×10-8mol/L
=10-10mol/L,代入Ksp(Fe(OH)3)=4×10-38=c(Fe3+)·c3(OH-),c(Fe3+)=4×10-8mol/L
考点:考查氧化还原等。

 期末集结号系列答案
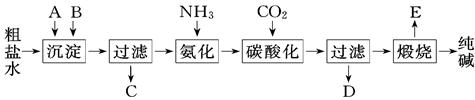
期末集结号系列答案纯碱、烧碱等是重要的化工原料。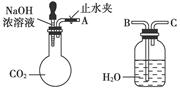
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,若其他操作不变,将A与C连接,可观察到的现象是 。
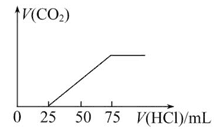
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
| A.NaOH和Na2CO3; | |
| B.; | |
| C.; | D.。 |
| 实验操作 | 实验现象 | 结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| (2) | | |


 NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法: