题目内容
为了探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断错误的是( )
| A、加入KHSO4固体,v(H2)变大 |
| B、加入少量食盐水,v(H2)减小 |
| C、加入Na2CO3固体,v(H2)减小 |
| D、滴加少量CuSO4溶液,v(H2)减小 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:锌为固体,与稀硫酸反应时,固体的表面积越大,溶液浓度越大或温度越高,以及形成原电池反应都可增大反应速率,以此解答.
解答:
解:A.加入NH4HSO4固体,NH4HSO4发生电离,溶液中c(H+)增大,反应速率加快,即v(H2)增大,故A正确;
B.加入少量食盐水,稀释溶液,溶液中c(H+)减小,反应速率减小,即v(H2)减小,故B正确;
C.加入碳酸钠,消耗硫酸,溶液中c(H+)减小,反应速率减小,即v(H2)减小,故C正确;
D.滴加少量CuSO4溶液,Zn置换出Cu,构成原电池,加快反应速率,故v(H2)增大,故D错误.
故选D.
B.加入少量食盐水,稀释溶液,溶液中c(H+)减小,反应速率减小,即v(H2)减小,故B正确;
C.加入碳酸钠,消耗硫酸,溶液中c(H+)减小,反应速率减小,即v(H2)减小,故C正确;
D.滴加少量CuSO4溶液,Zn置换出Cu,构成原电池,加快反应速率,故v(H2)增大,故D错误.
故选D.
点评:本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、0.1mol的D37Cl分子中的中子数是2NA |
| B、46g乙醇所含的羟基的电子数是7NA |
| C、2.3g Na与足量O2反应,生成Na2O和Na2O2的混合物,钠共失去0.1NA个电子 |
| D、18g葡萄糖分子中含有共用电子对数为2.2NA |
铅蓄电池是可充电型电池,电池总反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列说法正确的是( )
| 放电 |
| 充电 |
| A、该蓄电池放电工作时SO42-向正极移动 |
| B、充电时阳极的电极反应式是Pb+SO42--2e-═PbSO4 |
| C、用铅蓄电池电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加48g |
| D、铅蓄电池为电解电源,当蓄电池中有0.4mol H+被消耗时,电路中通过的电子的物质的量为0.4mol |
下列关于煤的叙述中不正确的是( )
| A、煤是工业上获得芳香烃的一种重要来源 |
| B、煤的干馏过程属于化学变化 |
| C、煤是由多种有机物组成的混合物 |
| D、煤除了主要含有碳元素外,还含有少量的氢、氮、硫、氧等元素 |
下列说法错误的是( )
| A、MnO2、CuO、Fe三种物质的粉末都是黑色的,用浓盐酸不能将它们区别开 |
| B、虽然碘易溶于酒精而不易溶于水,但是不能用酒精来萃取碘水中的碘 |
| C、用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气 |
| D、用KSCN溶液可以检验硫酸亚铁溶液中是否含有铁离子 |
下列化学用语表达正确的是( )
A、乙酸分子比例模型: | ||
B、原于核内有18个中于的氯原干:
| ||
C、铬原于价电子层排布图 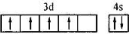 | ||
D、过氧化氢电子式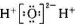 |