题目内容
【题目】合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。
己知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为: 2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①要使该反应速率和产率都增大,应该采取的措施是__________,减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是__________。
②一定条件下.上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________(单选,填标号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 变小
变小
③在某压强下,制备二甲醚的反应在不同温度、不冋投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则05 min内的平均反应速率v(CH3OCH3)=_____________;KA、 KB、 KC三者之间的大小关系为_______________。

(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是_________________。
②co的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释温度低于290℃时, CO转化率较高而CH3OCH3产率较低的原因可能是___________。

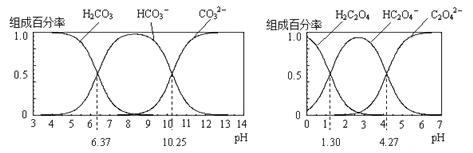
(3)用甲醇,二甲醚混合液与CO在催化剂条件下还可合成醋酸。常温下,醋酸的Ka=1.8×10-5,向 0.1 mol/L 醋酸溶液中滴加NaOH溶液至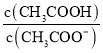 =
=![]() 时,混合溶液的pH=__________,醋酸钠水解反应的平衡常数值为__________。
时,混合溶液的pH=__________,醋酸钠水解反应的平衡常数值为__________。
【答案】 加压 催化剂 b 0.036mol·L-1·min-1 KA=KC>KB 2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g) ΔH=-204.7kJ·mol-1 CO的转化均为放热反应,温度较低时转化率较高,但CO转化为中间产物较多,转化为目标产物较少 5 5.6×10-10
【解析】(1)①已知:ⅰ、CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1=-49.0kJ·mol-1,ⅱ、2CH3OH(g)
CH3OH(g)+H2O(g)△H1=-49.0kJ·mol-1,ⅱ、2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H3=-24.5 kJ·mol-1,根据盖斯定律可知ⅰ×2+ⅱ即得到2CO2(g)+6H2(g)
CH3OCH3(g)+H2O(g)△H3=-24.5 kJ·mol-1,根据盖斯定律可知ⅰ×2+ⅱ即得到2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,即该反应是放热的体积减小的可逆反应,所以要使该反应速率和产率都增大,应该采取的措施是加压,减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是催化剂。②a.逆反应速率先增大后减小说明平衡向逆反应方向进行,a错误;b.H2的转化率增大说明平衡一定向正反应方向移动,b正确;c.反应物的体积百分含量减小平衡不一定向正反应方向进行,c错误;d.容器中的
CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,即该反应是放热的体积减小的可逆反应,所以要使该反应速率和产率都增大,应该采取的措施是加压,减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是催化剂。②a.逆反应速率先增大后减小说明平衡向逆反应方向进行,a错误;b.H2的转化率增大说明平衡一定向正反应方向移动,b正确;c.反应物的体积百分含量减小平衡不一定向正反应方向进行,c错误;d.容器中的![]() 变小平衡不一定向正反应方向进行,d错误,答案选b;③T1温度下,将6molCO2和12molH2充入10L的密闭容器中,根据图像可知平衡时CO2转化率是0.6,则消耗CO2是3.6mol,生成二甲醚是1.8mol,浓度是0.18mol/L,所以05 min内的平均反应速率v(CH3OCH3)=0.18mol/L÷5min=0.036mol·L-1·min-1;正反应放热,温度越低CO2转化率越高,平衡常数越大,温度是T1<T2,由于平衡常数只与温度有关系,所以KA、 KB、 KC三者之间的大小关系为KA=KC>KB。(2)①己知:ⅲ、2CO2(g)+6H2(g)
变小平衡不一定向正反应方向进行,d错误,答案选b;③T1温度下,将6molCO2和12molH2充入10L的密闭容器中,根据图像可知平衡时CO2转化率是0.6,则消耗CO2是3.6mol,生成二甲醚是1.8mol,浓度是0.18mol/L,所以05 min内的平均反应速率v(CH3OCH3)=0.18mol/L÷5min=0.036mol·L-1·min-1;正反应放热,温度越低CO2转化率越高,平衡常数越大,温度是T1<T2,由于平衡常数只与温度有关系,所以KA、 KB、 KC三者之间的大小关系为KA=KC>KB。(2)①己知:ⅲ、2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,ⅳ、CO2(g)+H2(g)
CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,ⅳ、CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.1 kJ·mol-1,根据盖斯定律可知ⅲ+ⅳ×2即得到热化学方程式是2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=-204.7kJ·mol-1。②由于CO的转化均为放热反应,温度较低时转化率较高,但CO转化为中间产物较多,所以转化为目标产物较少;(3)根据醋酸的电离平衡常数表达式
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1,根据盖斯定律可知ⅲ+ⅳ×2即得到热化学方程式是2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=-204.7kJ·mol-1。②由于CO的转化均为放热反应,温度较低时转化率较高,但CO转化为中间产物较多,所以转化为目标产物较少;(3)根据醋酸的电离平衡常数表达式 可知c(H+)=
可知c(H+)=  =10-5mol/L,所以混合溶液的pH=5,醋酸钠水解反应的平衡常数值为
=10-5mol/L,所以混合溶液的pH=5,醋酸钠水解反应的平衡常数值为![]() =5.6×10-10。
=5.6×10-10。

 阅读快车系列答案
阅读快车系列答案