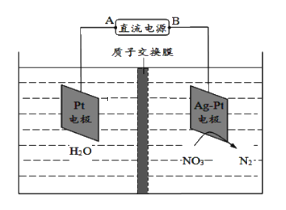
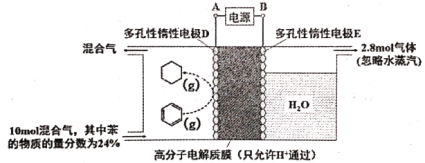
题目内容
【题目】C和H2在生产、生活、科技中是非常重要,已知:①2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
②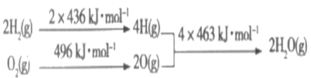
下列推断正确的是
A.C(s)的燃烧热为110.5kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1
C.C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1
D.将2mol H2O(l)分解成H2(g)和O2(g),至少需要提供4×463kJ的热量
【答案】C
【解析】
A. 1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为燃烧热;
B. 2molH2断开化学键需要吸收的热量为2mol×436 kJ·mol-1,1mol O2断开化学键需要吸收的热量为1mol×496 kJ·mol-1,4molH原子和2molO原子形成2molH2O(g)时放出的热量为4mol×463 kJ·mol-1,根据△H=反应物的总键能-生成物的总键能进行计算,并书写热化学方程式;
C. 由反应①2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1和反应②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1,可知反应①-②得C(s)+H2O(g)=CO(g)+H2(g);
D. 根据已知条件②可知2mol H2O(g)分解成H2(g)和O2(g),提供的热量为4×463kJ。
A.1mol C(s)完全燃烧生成稳定的氧化物即CO2时所放出的热量为燃烧热,A项错误;
B.2molH2断开化学键需要吸收的热量为2mol×436 kJ·mol-1,1mol O2断开化学键需要吸收的热量为1mol×496 kJ·mol-1,4molH原子和2molO原子形成2molH2O(g)是时放出的热量为4mol×463 kJ·mol-1,根据△H=反应物的总键能-生成物的总键能,可得△H=2mol×436 kJ·mol-1+1mol×496 kJ·mol-1-4mol×463 kJ·mol-1=-484 kJ·mol-1,因此热化学方程式为:2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1,B项错误;
C.由反应①2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1和反应②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1,可知反应①-②得C(s)+H2O(g)=CO(g)+H2(g),△H=+131.5 kJ·mol-1,即热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1,C项正确;
D.根据已知条件②可知2mol H2O(g)分解成H2(g)和O2(g),提供的热量为4×463kJ,D项错误;
答案选C。

 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
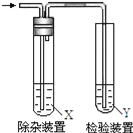
新黄冈兵法密卷系列答案【题目】欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
小组 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
A.AB.BC.CD.D